题目内容
9.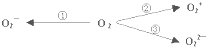 据2004年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子.
据2004年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子.(1)下列有关O4的说法正确的是:C
A.O4分子内存在极性共价键
B.合成O4的反应可看作核聚变反应,即不属于化学变化
C.O4与O3、O2都是氧的同素异形体
D.O4不可用作氧化剂
(2)制备含O2-、O22-甚至O2+的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:上述反应中,②(填序号)相当于氧分子的氧化;①③(填序号)相当于氧分子的还原.
(3)写出O22-的电子式:

(4)O2[PtF6]是一种含有O2+的化合物,请写出一种含有O2-的氧化物的化学式:KO2.
分析 (1)O4为单质,只含非极性键,与O3、O2都是氧元素的单质;
(2)氧分子的氧化,氧元素的化合价升高;氧分子的还原中,氧元素的化合价降低;
(3)O22-中O原子之间通过1个共用电子对结合;
(4)O2-中离子带一个负电荷,形成化合物时另一个阳离子带一个正电荷,根据常见的第IA族元素分析.
解答 解:(1)A.O4分子内只存在O-O非极性共价键,故A错误;
B.合成O4的反应,有新物质生成,属于化学变化,故B错误;
C.O4与O3、O2都是氧的不同单质,互为同素异形体,故C正确;
D.O4是一种高能量分子,具有强氧化性,则将来可用作更强有力的火箭推进的氧化剂,故D错误;
故答案为:C;
(2)氧分子的氧化,氧元素的化合价升高,只有②符合;氧分子的还原中,氧元素的化合价降低,①③符合,故答案为:②;①③;
(3)O22-中O原子之间通过1个共用电子对结合,则O22-的电子式为: ,故答案为:
,故答案为: ;
;
(4)O2-中离子带一个负电荷,形成化合物时另一个阳离子带一个正电荷,常见的第IA族元素中K元素能形成KO2,故答案为:KO2.
点评 本题以信息考查化学键,为高频考点,把握习题中的信息及化学键的判断为解的关键,侧重分析能力及知识迁移应用能力的考查,题目难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
20.一定温度下,向2.0L恒容密闭容器中充入1.0mol A,经一段时间后反应A(g)?B(g)+C(g)达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(B)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 前50 s内B的平均反应速率v(B)=0.0032 mol•L-1•s-1 | |
| B. | 相同温度下,若达到平衡后向容器中继续充入A,则平衡向右移动,平衡常数增大 | |
| C. | 相同温度下,若起始时向容器中充入1.0 mol A、0.20 mol B和0.20 mol C,则达到平衡前v(正)>v(逆) | |
| D. | 若保持其他条件不变,升高温度,平衡时,平衡常数K=0.2 mol•L-1,则反应的△H<0 |
17.下列叙述正确的是( )
| A. | H2D与H2T互为同素异形体 | |
| B. | 不同元素的原子构成的分子只含极性共价键 | |
| C. | ${\;}_{92}^{235}$U和${\;}_{92}^{238}$U是中子数不同、质子数相同的同种核素 | |
| D. | 短周期第 IVA与第 VIIA族元素的原子间构成的分子,均满足原子最外层8电子结构 |
4.某科研小组发现一种新型的有机物--全氟丙烷(C3F8),下列有关全氟丙烷的说法正确的是( )
| A. | 分子中三个碳原子可能处在同一直线上 | |
| B. | 它的五氯代物数目与三氯代物的数目相等 | |
| C. | 它属于烃类 | |
| D. | 该物质易溶于水,难溶于有机物 |
8.一定条件下的反应:PCl5(g)?PCl3(g)+Cl2(g)(正反应吸热)达到平衡后,下列情况使PCl5分解率降低的是 ( )
| A. | 温度、体积不变,充入氩气 | B. | 条件不变,对体系加热 | ||
| C. | 温度、体积不变,充入氯气 | D. | 温度不变,增大容器体积 |
6.下列物质中同分异构体数目最多的是( )
| A. | C2H6O | B. | C3H8O | C. | C3H6BrCl | D. | C4H9Cl |