题目内容
【题目】Ⅰ、实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
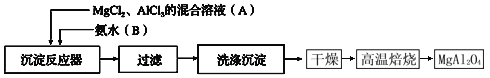
(1)写出AlCl3与氨水反应的化学反应方程式 _________________________________。
(2)判断流程中沉淀是否洗净所用的试剂是______________,高温焙烧时,用于盛放固体的仪器名称是 ________________。
Ⅱ、无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
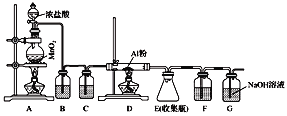
(3)其中装置A用来制备氯气,写出其离子反应方程式:______________________。
(4)装置B中盛放饱和NaCl溶液,该装置的主要作用是_____________________。
(5)F中试剂是________。G为尾气处理装置,其中反应的化学方程式:____________________。
(6)制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:与足量AgNO3溶液反应,称量生成的AgCl质量。此方案_______(填“可行”,“不可行”),理由是__________________________________________。
【答案】 AlCl3+3NH3·H2O===Al(OH)3↓+3NH4Cl 硝酸酸化的硝酸银 坩埚 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 除去混在氯气中的氯化氢 浓硫酸 Cl2+2NaOH===NaCl+NaClO+H2O 不可行 硝酸银不仅和过量的盐酸反应,也会和氯化锰反应生成沉淀
Mn2++Cl2↑+2H2O 除去混在氯气中的氯化氢 浓硫酸 Cl2+2NaOH===NaCl+NaClO+H2O 不可行 硝酸银不仅和过量的盐酸反应,也会和氯化锰反应生成沉淀
【解析】(1)AlCl3与氨水反应的化学方程式为:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl。
(2)MgCl2、AlCl3的混合溶液与过量氨水反应后生成Mg(OH)2和Al(OH)3沉淀和NH4Cl溶液,所以沉淀上吸附的杂质是NH4Cl,沉淀是否洗涤干净的标志是判断最后一次洗涤液中是否含有Cl-,故可向最后一次洗涤液中加入硝酸酸化的硝酸银溶液,若不变浑浊,说明已洗涤干净,反之,未洗涤干净;高温焙烧时需要采用耐高温的仪器,故使用的仪器为耐高温的坩埚。
(3)实验室用MnO2和浓盐酸在加热条件下制取氯气,离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(4)浓盐酸容易挥发,为了得到纯净的氯气,必须除去HCl,因为HCl易溶于水,Cl2在饱和NaCl溶液中的溶解度较小,所以饱和NaCl溶液的作用是:除去混在氯气中的氯化氢。
(5)为了防止AlCl3遇潮湿空气产生大量白雾,必须防止空气中的和G装置中的水蒸汽进入D装置试管中,所以F中的试剂为浓硫酸;Cl2有毒污染环境,可用NaOH溶液吸收,对应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O。
(6)浓盐酸反应一段时间后浓度变小,反应停止,最后溶液中的溶质为HCl和MnCl2,加入硝酸银,两者均产生沉淀AgCl,故无法通过沉淀的质量来测定剩余盐酸的浓度,故方案不可行。答案为:不可行、硝酸银不仅和过量的盐酸反应,也会和氯化锰反应生成沉淀。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案