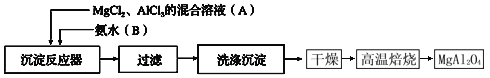
题目内容
【题目】如图为长式周期表的一部分,其中的编号代表对应的元素. 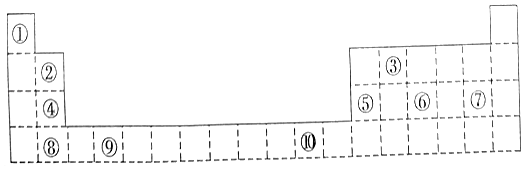
请回答下列问题:
(1)表中属于d区元素的是(填元素符号).
(2)⑥和⑦形成的分子中各个原子均满足8电子稳定结构,其立体构型为 .
(3)某元素原子的外围电子排布式为nsnnpn+1 , 该元素原子和⑦形成的分子,中心原子上的价层电子对数为 .
(4)元素⑦和⑧形成的化合物的电子式为 .
(5)元素⑩的基态+2价离子的电子排布式是 .
(6)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质.请写出元素②的氢氧化物与NaOH溶液反应的化学方程式: .
【答案】
(1)Ti
(2)三角锥形
(3)4
(4)![]()
(5)1s22s22p63s23p63d9或[Ar]3d9
(6)Be(OH)2+2NaOH═Na2BeO2+2H2O
【解析】解:由元素在周期表中的位置可知,①为H,②为Be,③为C,④为Mg,⑤为Al,⑥为P,⑦为Cl,⑧为Ca,⑨为Ti,⑩为Cu,(1)d区元素在副族元素和过渡元素区,Cu位于ds区,只有Ti位于d区, 所以答案是:Ti;(2)P和Cl形成PCl3或PCl5 , 分子中各个原子能均满足8电子稳定结构的是PCl3 , 价层电子对数为3+ ![]() =4,孤对电子1对,则立体构型为三角锥形,所以答案是:三角锥形;(3)电子排布式为nsnnpn+1 , n只能为2,外围电子排布式为:2s22p3 , 则该元素为N,与Cl形成的分子为NCl3 , 价层电子对数为3+
=4,孤对电子1对,则立体构型为三角锥形,所以答案是:三角锥形;(3)电子排布式为nsnnpn+1 , n只能为2,外围电子排布式为:2s22p3 , 则该元素为N,与Cl形成的分子为NCl3 , 价层电子对数为3+ ![]() =4,所以答案是:4;(4)Cl和Ca形成的化合物氯化钙是离子化合物,电子式为:
=4,所以答案是:4;(4)Cl和Ca形成的化合物氯化钙是离子化合物,电子式为: ![]() ,
,
所以答案是: ![]() ;(5)元素⑩为Cu,核外电子是29个,它的基态原子核外电子排布式是:1s22s22p63s23p63d104s1或[Ar]3d104s1 , 二价阳离子的电子排布式为:1s22s22p63s23p63d9或[Ar]3d9 , 所以答案是:1s22s22p63s23p63d9或[Ar]3d9;(6)元素②的氢氧化物与NaOH溶液反应反应生成Na2BeO2 , 该反应为Be(OH)2+2NaOH═Na2BeO2+2H2O,所以答案是:Be(OH)2+2NaOH═Na2BeO2+2H2O.
;(5)元素⑩为Cu,核外电子是29个,它的基态原子核外电子排布式是:1s22s22p63s23p63d104s1或[Ar]3d104s1 , 二价阳离子的电子排布式为:1s22s22p63s23p63d9或[Ar]3d9 , 所以答案是:1s22s22p63s23p63d9或[Ar]3d9;(6)元素②的氢氧化物与NaOH溶液反应反应生成Na2BeO2 , 该反应为Be(OH)2+2NaOH═Na2BeO2+2H2O,所以答案是:Be(OH)2+2NaOH═Na2BeO2+2H2O.

【题目】下表中关于物质分类的正确组合是 ( )
类别组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
A | CO2 | CuO | H2SO4 | NH3·H2O | Na2S |
B | CO | Na2O | HCl | NaOH | NaCl |
C | SO2 | Na2O2 | CH3COOH | KOH | CaF2 |
D | NO2 | CaO | HNO3 | Cu(OH)2CO3 | CaCO3 |