��Ŀ����
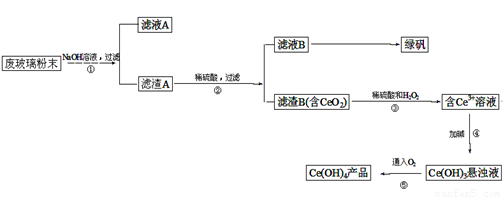
�������棨CeO2����һ����Ҫ��ϡ�������ƽ�������ʾ�����������в��������ķϲ�����ĩ����SiO2��Fe2O3��CeO2�����ʣ���ij�����Դ˷�ĩΪԭ�ϣ���Դ���յĹ����������£�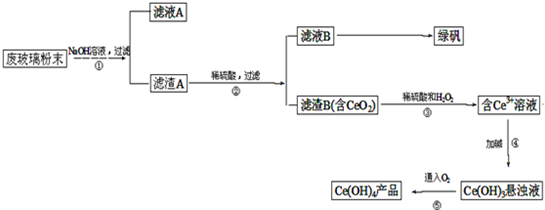
��1��д���ڢٲ���Ӧ�����ӷ���ʽ
��2��ϴ������B��Ŀ����Ϊ�˳�ȥ
��3��д���ڢ۲���Ӧ�Ļ�ѧ����ʽ
��4���Ʊ��̷���FeSO4?7H2O��ʱ����Fe2��SO4��3��Һ�м��������м����ַ�Ӧ�����˵õ�FeSO4��Һ���پ�
��5��ȡ���������еõ���Ce��OH��4��Ʒ����������Ϊ97%��1.0g���������ܽ����0.1000mol/LFeSO4��Һ�ζ����յ㣨�汻��ԭ��Ce3+��������ȷ�μӱ���Һ�����Ϊ
��6��д���ڢݲ���Ӧ�Ļ�ѧ����ʽ
�������ڢٲ���Ӧ�ϲ�����ĩ������������Һ����ˣ��õ�����A�ijɷ���Fe2O3��CeO2������A��Fe2O3��CeO2����ϡ�������˵���ҺB����������Һ������B�ijɷ���CeO2���ڢ۲���ӦCeO2��H2O2��ϡH2SO4��Ӧ����Ce3+��O2���ڢܲ���ӦCe3+�Ӽ�����Ce��OH��3����Һ���ڢݲ���ӦCe��OH��3����Һ����������Ce��OH��4��
��1�����ݷϲ�����ĩ�ijɷ֣���SiO2��Fe2O3��CeO2�����ʣ�����֪�����������Ʒ�Ӧ��ֻ�ж������裮�����ӷ���ʽΪSiO2+2OH-�TSiO32-+H2O��
��2������������A�ijɷ���Fe2O3��CeO2���ڢڲ���ӦFe2O3��ϡ������������Fe2��SO4��3��ϴ������B��Ŀ����Ȼ��Ϊ�˳�ȥ Fe3+�������������Ƿ�ϴ���ķ�����ȡ���һ��ϴ��Һ������KSCN��Һ���������ֺ�ɫ������ϴ��������δϴ����
��3���ڢ۲���ӦCeO2��H2O2��ϡH2SO4��Ӧ����Ce3+��CeԪ����+4�۱�Ϊ+3�ۣ�����ԭ����H2O2Ӧ����������O2��Ȼ����ƽ�ó��ڢ۲���Ӧ�Ļ�ѧ����ʽ��
��4���̷���FeSO4?7H2O���ǽᾧˮ�����������ֽ⣻����FeSO4��Һ�Ʊ��̷���FeSO4?7H2O��ʱ��Ӧ�� ����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����Ȳ�������õ���
��5������֪������ȡ���������еõ���Ce��OH��4��Ʒ����������Ϊ97%��1.0g���������ܽ����0.1000mol/LFeSO4��Һ�ζ����յ㣬�汻��ԭ��Ce3+����Fe2+��������ΪFe3+�������غ���ʽ����ɵ���ȷ�μӱ���Һ�������
��6���ڢݲ���ӦCe��OH��3����Һ����������Ce��OH��4��
��1�����ݷϲ�����ĩ�ijɷ֣���SiO2��Fe2O3��CeO2�����ʣ�����֪�����������Ʒ�Ӧ��ֻ�ж������裮�����ӷ���ʽΪSiO2+2OH-�TSiO32-+H2O��
��2������������A�ijɷ���Fe2O3��CeO2���ڢڲ���ӦFe2O3��ϡ������������Fe2��SO4��3��ϴ������B��Ŀ����Ȼ��Ϊ�˳�ȥ Fe3+�������������Ƿ�ϴ���ķ�����ȡ���һ��ϴ��Һ������KSCN��Һ���������ֺ�ɫ������ϴ��������δϴ����
��3���ڢ۲���ӦCeO2��H2O2��ϡH2SO4��Ӧ����Ce3+��CeԪ����+4�۱�Ϊ+3�ۣ�����ԭ����H2O2Ӧ����������O2��Ȼ����ƽ�ó��ڢ۲���Ӧ�Ļ�ѧ����ʽ��
��4���̷���FeSO4?7H2O���ǽᾧˮ�����������ֽ⣻����FeSO4��Һ�Ʊ��̷���FeSO4?7H2O��ʱ��Ӧ�� ����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����Ȳ�������õ���
��5������֪������ȡ���������еõ���Ce��OH��4��Ʒ����������Ϊ97%��1.0g���������ܽ����0.1000mol/LFeSO4��Һ�ζ����յ㣬�汻��ԭ��Ce3+����Fe2+��������ΪFe3+�������غ���ʽ����ɵ���ȷ�μӱ���Һ�������
��6���ڢݲ���ӦCe��OH��3����Һ����������Ce��OH��4��
����⣺��1�����ݷϲ�����ĩ�ijɷ֣���SiO2��Fe2O3��CeO2�����ʣ�����֪�����������Ʒ�Ӧ���Ƕ������裬�����ӷ���ʽΪSiO2+2OH-�TSiO32-+H2O��
�ʴ�Ϊ��SiO2+2OH-�TSiO32-+H2O��
��2������������A�ijɷ���Fe2O3��CeO2���ڢڲ���ӦFe2O3��ϡ������������Fe2��SO4��3��ϴ������B��Ŀ����Ȼ��Ϊ�˳�ȥ Fe3+�������������Ƿ�ϴ���ķ�����ȡ���һ��ϴ��Һ������KSCN��Һ���������ֺ�ɫ������ϴ��������δϴ����
�ʴ�Ϊ��Fe3+��ȡ���һ��ϴ��Һ������KSCN��Һ���������ֺ�ɫ������ϴ��������δϴ����
��3���ڢ۲���ӦCeO2��H2O2��ϡH2SO4��Ӧ����Ce3+��CeԪ����+4�۱�Ϊ+3�ۣ�����ԭ����H2O2Ӧ����������O2��Ȼ����ƽ�ó��ڢ۲���Ӧ�Ļ�ѧ����ʽ 2CeO2+H2O2+3H2SO4�T2Ce2��SO4��3+O2��+4H2O��
�ʴ�Ϊ��2CeO2+H2O2+3H2SO4�T2Ce2��SO4��3+O2��+4H2O��
��4���̷���FeSO4?7H2O���ǽᾧˮ�����������ֽ⣻����FeSO4��Һ�Ʊ��̷���FeSO4?7H2O��ʱ��Ӧ�� ����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����Ȳ�������õ���
�ʴ�Ϊ������Ũ������ȴ�ᾧ��
��5������֪������ȡ���������еõ���Ce��OH��4��Ʒ����������Ϊ97%��1.0g���������ܽ���Ce4+����0.1000mol/LFeSO4��Һ�ζ����յ㣬�汻��ԭ��Ce3+����Fe2+������ΪFe3+�������غ���ʽn��Ce��OH��4��=n��FeSO4��=
=0.004663mol���ɵ���ȷ�μӱ���Һ�����=
=0.04663L=46.63mL��
�ʴ�Ϊ��46.63��
��6���ڢݲ���ӦCe��OH��3����Һ�������е�������������Ce��OH��4����Ӧ�Ļ�ѧ����ʽΪ��4Ce��OH��3+O2+2H2O�T4Ce��OH��4��
�ʴ�Ϊ��4Ce��OH��3+O2+2H2O�T4Ce��OH��4��
�ʴ�Ϊ��SiO2+2OH-�TSiO32-+H2O��
��2������������A�ijɷ���Fe2O3��CeO2���ڢڲ���ӦFe2O3��ϡ������������Fe2��SO4��3��ϴ������B��Ŀ����Ȼ��Ϊ�˳�ȥ Fe3+�������������Ƿ�ϴ���ķ�����ȡ���һ��ϴ��Һ������KSCN��Һ���������ֺ�ɫ������ϴ��������δϴ����
�ʴ�Ϊ��Fe3+��ȡ���һ��ϴ��Һ������KSCN��Һ���������ֺ�ɫ������ϴ��������δϴ����
��3���ڢ۲���ӦCeO2��H2O2��ϡH2SO4��Ӧ����Ce3+��CeԪ����+4�۱�Ϊ+3�ۣ�����ԭ����H2O2Ӧ����������O2��Ȼ����ƽ�ó��ڢ۲���Ӧ�Ļ�ѧ����ʽ 2CeO2+H2O2+3H2SO4�T2Ce2��SO4��3+O2��+4H2O��
�ʴ�Ϊ��2CeO2+H2O2+3H2SO4�T2Ce2��SO4��3+O2��+4H2O��
��4���̷���FeSO4?7H2O���ǽᾧˮ�����������ֽ⣻����FeSO4��Һ�Ʊ��̷���FeSO4?7H2O��ʱ��Ӧ�� ����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����Ȳ�������õ���
�ʴ�Ϊ������Ũ������ȴ�ᾧ��
��5������֪������ȡ���������еõ���Ce��OH��4��Ʒ����������Ϊ97%��1.0g���������ܽ���Ce4+����0.1000mol/LFeSO4��Һ�ζ����յ㣬�汻��ԭ��Ce3+����Fe2+������ΪFe3+�������غ���ʽn��Ce��OH��4��=n��FeSO4��=
| 1.0g��97% |
| 208g/mol |
| 0.004663mol |
| 0.1000mol/L |
�ʴ�Ϊ��46.63��
��6���ڢݲ���ӦCe��OH��3����Һ�������е�������������Ce��OH��4����Ӧ�Ļ�ѧ����ʽΪ��4Ce��OH��3+O2+2H2O�T4Ce��OH��4��
�ʴ�Ϊ��4Ce��OH��3+O2+2H2O�T4Ce��OH��4��
�����������Թ�������Ϊ�����������˻�ѧʵ�����������Ԫ�ؼ�������֪ʶ����ѧ���㡢������ԭ��Ӧ�����֪ʶ����Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
ij��ѧ�����ö������棨CeO2����̫���������½�H2O��CO2ת��ΪH2��CO����������£�
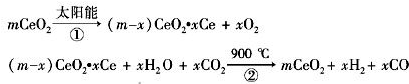
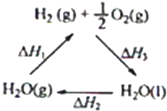
����˵������ȷ���ǣ�������
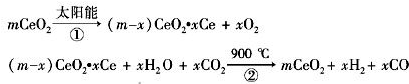
����˵������ȷ���ǣ�������
| A���ù�����CeO2û������ | B���ù���ʵ����̫������ѧ�ܵ�ת�� | C����ͼ�С�H1=��H2+��H3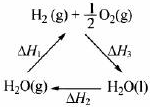 | D����CO��O2���ɵļ���ȼ�ϵ�صĸ�����ӦʽΪCO+4OH--2e-�TCO32-+2H2O |
 ij��ѧ�����ö������棨CeO2����̫���������½�H2O��CO2ת���H2��CO����������£�
ij��ѧ�����ö������棨CeO2����̫���������½�H2O��CO2ת���H2��CO����������£�mCeO2
| ̫���� |
| �� |
��m-x��CeO2?xCe+xH2O+xCO2
| 900�� |
| �� |
����˵������ȷ���ǣ�������
| A���ù�����CeO2û������ |
| B���ù���ʵ����̫������ѧ�ܵ�ת�� |
| C��ͼ�С�H1=��H2+��H3 |
| D����CO��O2���ɵļ���ȼ�ϵ�صĸ�����ӦʽΪCO+4OH--2e-=CO32-+2H2O |