题目内容
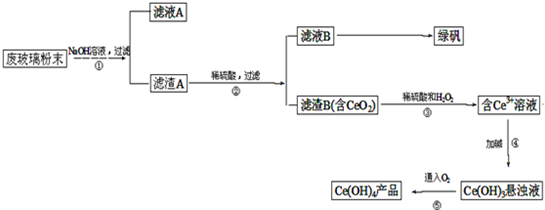
二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题以此粉末为原料,资源回收的工艺流程如下:
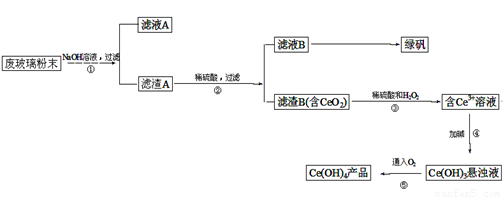
(1)写出第①步反应的离子方程式 。
(2)洗涤滤渣B的目的是为了除去____(填离子符号),检验该离子是否洗净的方法是 。
(3)写出第③步反应的化学方程式_____________________________。
(4)制备绿矾(FeSO4·7H2O)时,向Fe2(SO4)3溶液中加入过量铁屑,充分反应后,经过滤得到FeSO4溶液,再经 、 、过滤、洗涤、干燥等操作步骤得到绿矾。
(5)取上述流程中得到的Ce(OH)4产品(质量分数为97%)1.0g,加硫酸溶解后,用0.1000mol/LFeSO4溶液滴定至终点(铈被还原成Ce3+),则需准确滴加标准溶液的体积为 mL。
(1)SiO2+2OH-=SiO32-+H2O(2分)
(2)Fe3+(2分);取最后一次洗涤液,加入KSCN溶液,若不出现红色,则已洗净;否
则未洗净(2分,其他合理答案给分)
(3)2CeO2+ H2O2 + 3H2SO4 = 2Ce2(SO4)3 + O2↑+ 4H2O(2分)
(4)蒸发浓缩、冷却结晶(每空1分,共2分)
(5)46.63(2分,需保留小数点后两位)
【解析】
试题分析:这是一道常见的物质提纯的题。(1)加入强碱是为了除去其中的二氧化硅;(2)洗涤滤渣的目的是为了除去三价铁离子;用硫氰化钾来检验是否除净了三价铁离子;(3)这一步是用过氧化氢来还原二氧化铈,二氧化铈被还原为正三价,过氧化氢被氧化为氧气;(4)结晶的过程总是得蒸发浓缩冷却结晶;
(5)2Ce(OH)4+2FeSO4+4H2SO4=Ce2(SO4)3 + Fe2(SO4)3+11H2O
416g 2mol
0.97g 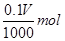
416g×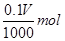 =0.97g×2mol
=0.97g×2mol
解之得:V=46.63 mL
考点:以工艺流程为基础,考察化学实验基本操作、元素及化合物知识、化学计算、氧化还原反应等相关知识

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案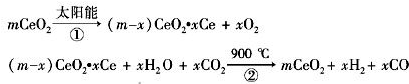
下列说法不正确的是( )
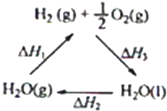
| A、该过程中CeO2没有消耗 | B、该过程实现了太阳能向化学能的转化 | C、右图中△H1=△H2+△H3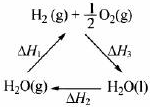 | D、以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-═CO32-+2H2O |
 某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如下:
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如下:mCeO2
| 太阳能 |
| ① |
(m-x)CeO2?xCe+xH2O+xCO2
| 900℃ |
| ① |
下列说法不正确的是( )
| A、该过程中CeO2没有消耗 |
| B、该过程实现了太阳能向化学能的转化 |
| C、图中△H1=△H2+△H3 |
| D、以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO32-+2H2O |