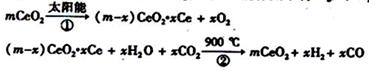题目内容
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO.其过程如下:
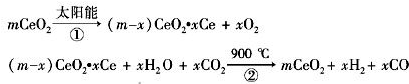
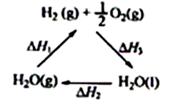
下列说法不正确的是( )
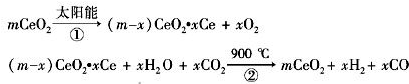
下列说法不正确的是( )
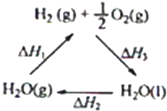
| A、该过程中CeO2没有消耗 | B、该过程实现了太阳能向化学能的转化 | C、右图中△H1=△H2+△H3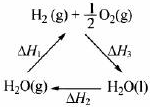 | D、以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-═CO32-+2H2O |
分析:A、总反应为:H2O+CO2→H2+CO+O2,CeO2没有消耗,是催化剂;
B、该过程中在太阳能作用下将H2O、CO2转变为H2、CO;
C、根据盖斯定律,-△H1=△H2+△H3;
D、负极反应式正确;
B、该过程中在太阳能作用下将H2O、CO2转变为H2、CO;
C、根据盖斯定律,-△H1=△H2+△H3;
D、负极反应式正确;
解答:解:A、通过太阳能实现总反应:H2O+CO2→H2+CO+O2,CeO2没有消耗,CeO2是光催化剂,故A正确;
B、该过程中在太阳能作用下将H2O、CO2转变为H2、CO,所以把太阳能转变成化学能,故B正确;
C、由右图可知,根据盖斯定律,应该是:-△H1=△H2+△H3;故C错误;
D、CO在负极失电子生成CO2,在碱性条件下再与OH-生成CO32-,故负极反应式正确;故D正确;
故选C.
B、该过程中在太阳能作用下将H2O、CO2转变为H2、CO,所以把太阳能转变成化学能,故B正确;
C、由右图可知,根据盖斯定律,应该是:-△H1=△H2+△H3;故C错误;
D、CO在负极失电子生成CO2,在碱性条件下再与OH-生成CO32-,故负极反应式正确;故D正确;
故选C.
点评:本题考查了热化学知识和盖斯定律的应用,以及催化剂的判断,题目难度适中.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
 某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如下:
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如下:mCeO2
| 太阳能 |
| ① |
(m-x)CeO2?xCe+xH2O+xCO2
| 900℃ |
| ① |
下列说法不正确的是( )
| A、该过程中CeO2没有消耗 |
| B、该过程实现了太阳能向化学能的转化 |
| C、图中△H1=△H2+△H3 |
| D、以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO32-+2H2O |
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:
mCeO2 (m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2
(m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2 mCeO2+ xH2+ xCO
mCeO2+ xH2+ xCO
下列说法不正确的是
| A.该过程中CeO2没有消耗 |
| B.该过程实现了太阳能向化学能的转化 |
| C.右图中△H1=△H2+△H3 |
| D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—=CO32-+2H2O |
 (m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+
xCO2
(m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+
xCO2 mCeO2+ xH2+
xCO
mCeO2+ xH2+
xCO