��Ŀ����
����Ŀ����⾫��ͭ����������Ҫ�ɷ�ΪCu2Te��Ag2Se����ҵ�ϴ����л�����(Se)����(Te)��һ�ֹ����������£�
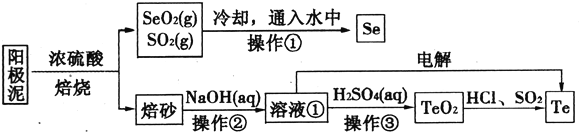
��֪��I��TeO2���������������ˮ��
����Ԫ��������Һ����Ҫ��Te4+��TeO32-��HTeO3-����ʽ���ڣ�
��25��ʱ��������(H2TeO3)��Ka1=1��10-3��Ka2=2��10-8��
��1��NaHTeO3����Һ��pH____7(����>������=������<��)��
��2��SeO2��SO2ͨ��ˮ�з�Ӧ�Ļ�ѧ����ʽΪ________�������ٵ�����Ϊ__________��
��3����ɰ������TeO2��ʽ���ڡ���Һ���е�������Ҫ�ɷ�ΪNaOH��_______����ҵ��ͨ�������Һ��Ҳ�ɵõ������ڡ���֪�缫��Ϊʯī���������ĵ缫��ӦʽΪ____________��
��4������Һ���м������ᣬ������Һ��pHΪ4.5��5.0������TeO2���������H2SO4�������������ڵĻ�����ƫ�ͣ���ԭ����________________________��
��5����������TeO2����������õ����Ȼ�����Һ��Ȼ��SO2ͨ�뵽��Һ�еõ�Te���ʡ������Ȼ��ڵõ�Te���ʵ����ӷ���ʽΪ__________________��
��6�����������п�ѭ�����õ�������__________________(�ѧʽ)��
���𰸡� < SeO2+2SO2+2H2O=2H2SO4+Se�� ���� Na2TeO3 TeO32-+3H2O+4e-=Te+6OH- TeO2����������������Һ���Թ�����TeO2��������ᷴӦ������Ԫ����ʧ Te4++2SO2+4H2O=Te+8H++2SO42- H2SO4��HCl
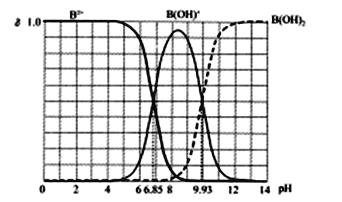
����������1�������ᣨH2SeO3����Ka1=1��10-3��Ka2=2��10-8����֪HSeO3-��ˮ�ⳣ��![]() ����֪Ka2��Kh������NaHSeO3��Һ�����ԣ�pH��7��
����֪Ka2��Kh������NaHSeO3��Һ�����ԣ�pH��7��
��2����������ͼ��֪��SeO2��SO2��Ӧ������Se���ʣ�����SeO2��SO2����������ʽΪSeO2+2SO2+2H2O=2H2SO4+Se����ͨ�����˿��Խ�Se����Һ���룬�ʴ�Ϊ��SeO2+2SO2+2H2O=2H2SO4+Se�������ˡ�
��3����֪��TeO2���������������ˮ��Ԫ��������Һ����Ҫ��Te4+��TeO32-��HTeO3-����ʽ���ڣ�����TeO2���������Ʒ�Ӧ��Ӧ������Na2TeO3��������Na2TeO3����Һ������Ӧ����TeO32-�õ��ӱ��Te���ʣ����Ե缫��ӦΪTeO32-+3H2O+4e-=Te+6OH-���ʴ�Ϊ��Na2TeO3 ��TeO32-+3H2O+4e-=Te+6OH-��
��4��TeO2����������������Һ���Թ�����TeO2��������ᷴӦ������Ԫ����ʧ��
��5��TeO2����ˮ�������ڽ�Ũ��ǿ���ǿ������ᷴӦʱ�������Ȼ��ں�ˮ�����Ȼ��ڿ��Խ�SO2���������������ӷ���ʽΪ��Te4++2SO2+4H2O=Te+8H++2SO42-��
��6��SeO2��SO2��Ӧ�����������ᣬ����H2SO4����ѭ��ʹ�ã�������TeO2����������õ����Ȼ�����Һ��Ȼ��SO2ͨ�뵽��Һ�еõ�Te���ʵ�ͬʱ�ֻ��ٴ�����HCl�����Կ�ѭ�����õ������У�H2SO4��HCl��