题目内容
【题目】氯化铵具有广泛用途,可用于选矿、医药等。
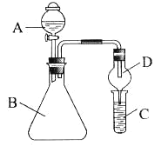
(1)实验室用氯化铵与熟石灰反应制取氨气的化学方程式为____,收集氨气时,可选用下图中的装置____(填字母)。
A B
B C
C![]()
(2)工业上为提高氯化铵产品的经济利用价值,常利用氢氧化镁和氯化铵共热制得氨气、碱式氯化镁[Mg(OH)Cl](520℃发生分解)。实验室模拟该工艺的装置图如下:

①冷凝管进水口是_____(填“a”或“b”)。
②实验中持续通入氮气的目的是_____。
③共热时,温度不宜过高的原因是_____。
④共热时,若氯化铵用量过大会导致Mg(OH)Cl中混有较多的杂质为_____(写化学式)。
(3)已知氧化钙与氯化铵溶液反应制备氯化钙的适宜温度为80℃。补充完整由氧化钙(含少量SiO2)、氯化铵溶液制备医用CaCl2·2H2O晶体的实验步骤:将氯化铵溶液、氧化钙粉末按照一定配比加入反应器中,_____,得到CaCl2溶液,_____、趁热过滤、洗涤、干燥。(实验中须使用的试剂:稀硫酸)
【答案】Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O B b 使装置内的NH3尽量排出 Mg(OH)Cl温度高时会分解 MgCl2 80℃水浴加热并不断搅拌,用硫酸溶液吸收蒸出的氨气,充分反应后过滤 将滤液蒸发结晶
CaCl2+2NH3↑+2H2O B b 使装置内的NH3尽量排出 Mg(OH)Cl温度高时会分解 MgCl2 80℃水浴加热并不断搅拌,用硫酸溶液吸收蒸出的氨气,充分反应后过滤 将滤液蒸发结晶
【解析】
⑴实验室用氯化铵与熟石灰反应制取氨气的化学方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O,氨气极易溶于水且密度比空气小,因此只能采用向下排空气法收集,只能用装置B来收集氨气,
CaCl2+2NH3↑+2H2O,氨气极易溶于水且密度比空气小,因此只能采用向下排空气法收集,只能用装置B来收集氨气,
故答案为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;B;
CaCl2+2NH3↑+2H2O;B;
⑵

①冷凝管进水口应下进上出,因此进口管是b,
故答案为b;
②实验中持续通入氮气的目的是使装置内的NH3尽量排出;
③共热时,根据信息Mg(OH)Cl在520℃发生分解,因此温度不宜过高的原因是Mg(OH)Cl温度高时会分解,
故答案为:Mg(OH)Cl温度高时会分解;
④共热时,若氯化铵用量过大,两者按照2:1反应生成氯化镁,因此用量过大会导致Mg(OH)Cl中混有较多的杂质MgCl2,
故答案为:MgCl2;
⑶已知氧化钙与氯化铵溶液反应制备氯化钙的适宜温度为80℃。所以由氧化钙(含少量SiO2)、氯化铵溶液制备医用CaCl2·2H2O晶体的实验步骤为:将氯化铵溶液、氧化钙粉末按照一定配比加入反应器中,控制水浴温度为80℃加热并不断搅拌,发生反应Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O,用硫酸溶液吸收蒸出的氨气,由于氧化钙中含有二氧化硅杂质,因此将反应后的溶液先过滤除去二氧化硅,再加热蒸发结晶、趁热过滤出氯化钙、洗涤、干燥。
CaCl2+2NH3↑+2H2O,用硫酸溶液吸收蒸出的氨气,由于氧化钙中含有二氧化硅杂质,因此将反应后的溶液先过滤除去二氧化硅,再加热蒸发结晶、趁热过滤出氯化钙、洗涤、干燥。
故答案为:80℃水浴加热并不断搅拌,用硫酸溶液吸收蒸出的氨气,充分反应后过滤;将滤液蒸发结晶。

 阅读快车系列答案
阅读快车系列答案【题目】某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
(1)配制250mL 0.2000 mol/L盐酸标准溶液,所需玻璃仪器有______、______量筒、烧杯、玻璃棒。
(2)盛装0.2000 mol/L盐酸标准液应该用______式滴定管。(填“酸”或“碱”)
(3)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_________,直到加入一滴盐酸后,溶液由_________,即到终点。
(4)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管;
④装标准溶液和待测液并调整液面(记录初始读数);
⑤用蒸馏水洗涤玻璃仪器;⑥滴定操作
正确的操作顺序为:_________。
(5)有关数据记录如下:
实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.60 | 20.70 |
2 | 20.00 | 6.00 | 25.90 |
3 | 20.00 | 1.40 | 23.20 |
则NaOH溶液的物质的量浓度为__________mol/L。
(6)若滴定时锥形瓶未干燥,则测定结果____________;若滴定前平视读数,滴定终点时仰视读数,则所测碱的浓度值_________。(填“无影响”、“偏高”或“偏低”)。