题目内容
已知短周期元素的离子aA2+、bB+ 、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A.原子序数:d>c>b>a
B.原子半径:r (A)>r (B) >r (D)> r (C)
C.单质的还原性:A>B >D>C
D.离子半径:r (C3-)>r (D-)>r (B+)>r (A2+)
D
解析试题分析:aA2+、bB+ 、cC3-、dD-都具有相同的电子层结构,根据“阴上阳下”的原则,A、B在下一周期,C、D在上一周期;A带的正电荷比B多,说明A在B的右侧,C带的负电荷比D多,说明C在D的左侧。A、根据以上分析,原子序数:a>b>d>c,错误;B、B、A同周期,A在B的右侧;C、D同周期C在D的左侧。原子半径r (B) >r (A) > r (C) >r (D),错误;C、根据元素周期律判断单质的还原性:B>A >C>D,错误;D、aA2+、bB+ 、cC3-、dD-都具有相同的电子层结构,离子半径的大小取决于核电荷数,核电荷数越多,离子半径越小,r (C3-)>r (D-)>r (B+)>r (A2+),正确,答案选D。
考点:考查原子结构的判断,元素周期律的应用

 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案J、Q、M、R、T是原子序数依次增大的短周期主族元素,J、Q、R在周期表中的相对位置如下表。已知J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。下列说法正确的是
| J | | Q |
| | | R |
A. J和氢元素形成的化合物分子中只含极性共价键
B. R、Q两元素形成的氢化物中,R的氢化物沸点更高
C. J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是H2RO4
D. M单质能与氢氧化钠溶液反应,其中水和氢氧化钠都是氧化剂
下列性质的递变中,正确的是
| A.O、Na、S的原子半径依次增大 | B.LiOH、KOH、CsOH的碱性依次增强 |
| C.HF、NH3、SiH4的稳定性依次增强 | D.HCl、HBr、HI的还原性依次减弱 |
某周期第二主族元素的原子序数为x,则同周期第三主族元素的原子序数是 ( )
| A.只有x+1 | B.可能是x+1或x+11或x+25 |
| C.可能是x+8 | D.可能是x+2 |
运用元素周期律分析下面的推断,其中错误的是 ( )
| A.砹(85号元素)是一种有色固体,HAt应该不稳定,且AgAt是有色难溶于水固体 |
| B.铍(Be)是一种金属,它的氧化物的水化物可能具有两性 |
| C.硫酸锶(SrSO4)是难溶于水和盐酸的的白色固体 |
| D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 |
短周期元素X、Y、Z在元素周期表中的位置如图,关于X、Y、 Z的说法正确的是 ( )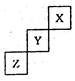
| A.相同条件下,三种元素的单质跟氢气反应时,X单质最剧烈 |
| B.由氢、氧和Z元素形成的常见化合物中既含有离子键又含有共价键 |
| C.ZO2能与Z的最高价氧化物对应的水化物反应生成Z单质 |
| D.Y的气态氢化物稳定性比Z的气态氢化物的稳定性强 |
关于下列图示的说法中不正确的是 ( ) 
| A.用图 ① 所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B.用图 ② 所示实验装置排空气法收集H2气体 |
C.图 ③ 表示可逆反应“CO(g)+H2O(g)  CO2(g)+H2(g)”为吸热反应 CO2(g)+H2(g)”为吸热反应 |
| D.图 ④两个装置中通过导线的电子数相同时,在正极上产生气体的物质的量也相同 |
元素的性质呈周期性变化的根本原因是( )
| A.元素的原子半径呈周期性变化 |
| B.元素原子量的递增,量变引起质变 |
| C.元素的金属性和非金属性呈周期性变化 |
| D.元素原子的核外电子排布呈周期性变化 |
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是
| A.Z、N两种元素的离子半径相比,前者较大 |
| B.X、N两种元素的气态氢化物的沸点相比,前者较低 |
| C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液 |