题目内容
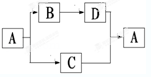
(10分)下图表示的反应关系中,部分产物被略去。已知2mol白色固体粉末X受热分解,恢复到室温生成白色固体A,无色液体B,无色气体C各1mol。X.E.G的焰色反应均为黄色。
回答下列问题:
(1)写出下列物质的化学式:A.
(2)写出X受热的化学反应方程式:
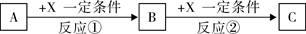
(3)写出X+E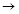 A的离子方程式:
A的离子方程式:
(4)写出C与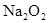 参加反应的化学方程式______________________________________,若0.2mol
参加反应的化学方程式______________________________________,若0.2mol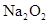 参加反应,则转移的电子数为_____________个。
参加反应,则转移的电子数为_____________个。
回答下列问题:

(1)写出下列物质的化学式:A.
(2)写出X受热的化学反应方程式:
(3)写出X+E
 A的离子方程式:
A的离子方程式: (4)写出C与
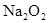 参加反应的化学方程式______________________________________,若0.2mol
参加反应的化学方程式______________________________________,若0.2mol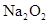 参加反应,则转移的电子数为_____________个。
参加反应,则转移的电子数为_____________个。(10分)(1) Na2CO3 (2) 2NaHCO3 Na2CO3 + CO2↑+ H2O
Na2CO3 + CO2↑+ H2O
(3) HCO3- + OH- = CO32- + H2O
(4) 2Na2O2 +2 CO2 ="2" Na2CO3 + O2 0.2NA
 Na2CO3 + CO2↑+ H2O
Na2CO3 + CO2↑+ H2O(3) HCO3- + OH- = CO32- + H2O
(4) 2Na2O2 +2 CO2 ="2" Na2CO3 + O2 0.2NA
本题是无机框图题,关键是找准突破点。B是液体,所以B是水。因此E是氢氧化钠,G是偏铝酸钠。2mol白色固体粉末X受热分解,因此X是碳酸氢钠,A是碳酸钠,C是CO2,D是氢氧化铝沉淀。在过氧化钠和CO2的反应中,过氧化钠既是氧化剂,又是还原剂,。所以根据方程式2Na2O2 +2 CO2 ="2" Na2CO3 + O2,如果0.2mol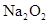 参加反应,则转移的电子数为0.2NA。
参加反应,则转移的电子数为0.2NA。
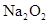 参加反应,则转移的电子数为0.2NA。
参加反应,则转移的电子数为0.2NA。
练习册系列答案
相关题目
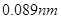 )
)