题目内容
8. 水是一种重要的自然资源,是人类赖以生存、不可或缺的物质,水质的优劣直接影响人体健康.海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.
水是一种重要的自然资源,是人类赖以生存、不可或缺的物质,水质的优劣直接影响人体健康.海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.(1)天然水净化处理过程中需要加入混凝剂,我们常用的混凝剂有明矾、硫酸铝、硫酸铁、硫酸亚铁,其净水作用的原理是铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉,达到净化目的.
(2)水的净化与软化的区别是水的净化是用混凝剂将水中胶体及悬浮物沉淀下来,软化是除去水中Ca2+和Mg2+.
(3)目前,国际上使用的“海水淡化”主要技术之一是蒸馏法.蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水.由此可判断蒸馏法是物理变化(填“物理变化”或“化学变化”).
(4)海水除了可以得到淡水外,还可从中提取多种化工原料.由海水制备无水氯化镁,主要有以下步骤:
①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶.其先后顺序正确的是D(填序号).
A.②④⑤③①B.③②④①⑤C.③④②⑤①D.②④③⑤①
(5)海水电解制得的氢气用于合成氨,某合成氨厂生产流程图如图所示:
①在第(1)个设备中先把N2和H2压缩的目的是使平衡向生成氨气的方向移动.
②在第(3)个设备中用冷却的方法分离出液氨,其目的是使平衡右移,提高氮气和氢气的转化率.
分析 (1)明矾、硫酸铝、硫酸铁等可水解生成具有吸附性的胶体;
(2)净水是除去水中的悬浮物,水的软化是除去水的钙离子和镁离子;
(3)根据蒸馏原理是利用物质沸点不同,可知温度进行分离混合物的分离方法判断;
(4)先生成氢氧化镁,氢氧化镁和盐酸反应生成氯化镁,易除去氯化钠等杂质;
(5)增大压强,可使平衡向正向移动,分离出生成物,可使平衡向正向移动,提高转化率.
解答 解:(1)混凝剂是吸附水中的微小悬浮颗粒,凝聚成较大的颗粒,而快速沉降的主要作用,要具备水解生成胶体的性质,所以常有铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,
故答案为:铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉,达到净化目的;
(2)明矾中铝离子水解生成胶体,使水中胶体及悬浮物沉淀下来,水的软化为降低水中钙、镁离子浓度,
故答案为:水的净化是用混凝剂将水中胶体及悬浮物沉淀下来,软化是除去水中Ca2+和Mg2+;
(3)根据蒸馏原理是利用物质沸点不同,可知温度进行分离混合物的分离方法,蒸馏是物理变化,
故答案为:物理变化;
(4)因海水中MgCl2的浓度较小,所以要经过富集这一过程:先加熟石灰形成沉淀:MgCl2+Ca(OH)2═Mg(OH)2+CaCl2,然后将沉淀过滤,接着将Mg(OH)2沉淀转化为MgCl2:Mg(OH)2+2HCl═MgCl2+2H2O,这样就实现了MgCl2富集,将溶液蒸发结晶得到六水合氯化镁晶体(MgCl2•6H2O)(这步是为了得到纯净的MgCl2),又因MgCl2 易水解,为防止MgCl2水解的水解,加热六水合氯化镁晶体必须在HCl氛围下中进行:MgCl2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCl2 +6H2O,顺序为②④③⑤①,
故答案为:D;
(5)①第(1)个设备中先把N2和H2压缩,可使压强增大,有利于使平衡向生成氨气的方向移动,
故答案为:使平衡向生成氨气的方向移动;
②在第(3)个设备中用冷却方法分离出液氨,生成物浓度降低,可使平衡向正向移动,提高转化率,
故答案为:液氨;使平衡右移,提高氮气和氢气的转化率.
点评 本题考查了物质的分离、提纯,为高频考点,侧重于学生的分析能力和实验能力的考查,注意从整体把握各步发生的反应,知道每一步操作的目的,再结合物质间的反应来分析解答,题目难度不大.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案| A. | 常温下0.1mol•L-1的下列溶液中:①NH4Al(SO4)2;②NH4Cl;③CH3COONH4,c(NH4+)由大到小的顺序为②>①>③ | |
| B. | 常温下0.4mol•L-1CH3COOH溶液和0.2mol•L-1NaOH溶液等体积混合后溶液显酸性,溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-1 Na2CO3溶液与0.2mol•L-1NaHCO3溶液等体积混合所得溶液中:c(CO32-)+2c(OH-)═c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 0.1mol•L-1的氨水与0.05mol•L-1H2C2O4溶液等体积混合所得溶液中:c(NH4+)+c(NH3•H2O)═2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4) |
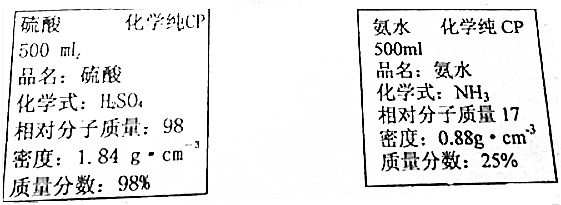
| A. | 该硫酸和氨水的物质的量浓度分别约为18.4mol•L-1和6.3mol•L-1 | |
| B. | 各取5mL与等质量的水混合后,c(H2SO4)<9.2mol•L-1,c(NH3)>6.45mol•L-1 | |
| C. | 各取5mL与等体积的水混合后,ω(H2SO4)<49%,ω(NH3)>12.5% | |
| D. | 各取10mL于两烧杯中,再分别加入一定量的水即可得到较稀的硫酸溶液和氨水 |
| A. | NaCl为离子晶体 | B. | SiO2为离子晶体 | C. | 干冰为原子晶体 | D. | 金刚石不是晶体 |
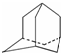 烃A分子的立体结构如图(其中C、H原子已略去);因其分子中碳原子排列类似金刚石故名“金刚烷”,金刚烷分子中有( )
烃A分子的立体结构如图(其中C、H原子已略去);因其分子中碳原子排列类似金刚石故名“金刚烷”,金刚烷分子中有( )| A. | 2个-CH3结构 | B. | 4个-CH2-结构 | C. | 4个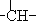 结构 结构 | D. | 6个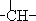 结构 结构 |
| A. | 海洋是一个巨大的资源宝库 | |
| B. | 海水中含量最多的盐是NaCl | |
| C. | 海水中所含有的常量元素大部分以单质形式存在 | |
| D. | 海水是镁元素的一个重要来源 |
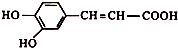 ,有关咖啡酸的说法中不正确的是( )
,有关咖啡酸的说法中不正确的是( )| A. | 咖啡酸分子式是C9H8O4 | |
| B. | 咖啡酸可以发生还原、取代、加聚等反应 | |
| C. | 1mol咖啡酸可以与4molH2发生加成反应 | |
| D. | 1mol咖啡酸最多能消耗3molNaHCO3 |
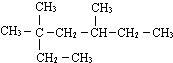 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷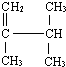 2,3-二甲基-1-丁烯
2,3-二甲基-1-丁烯 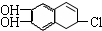 中含有的官能团的名称为羟基、碳碳双键和氯原子.
中含有的官能团的名称为羟基、碳碳双键和氯原子.