题目内容
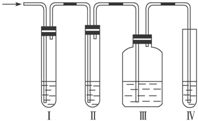
6.某研究性学习小组,用下列仪器、药品验证合金(由Cu、Fe、Zn三种物质组成)和适量浓硝酸反应产生的气体中含NO (N2和O2的用量可自由控制,气体沸点:NO2 21℃;NO-152℃)
(1)在图2中选择恰当的仪器将图1补充完整,所选择仪器的连接顺序(按左→右连接,填各仪器编号)为E→D→F
(2)反应前先通入N2目的是排尽装置中的空气,防止NO被氧化
(3)确认气体中含NO的操作及现象是D中烧瓶内通入O2后,无色气体变成红棕色
(4)如果O2过量,则装置F中发生反应的化学方程式为:4NO2+O2+4NaOH=4NaNO3
(5)本题中,浓硝酸(含溶质amol)完全反应,还原产物只有NO和NO2,被还原硝酸的物质的量n的取值范围为$\frac{a}{4}$mol<n<$\frac{a}{2}$mol.
分析 (1)金属与浓硝酸反应会生成二氧化氮,要验证NO的生成,则先冷却使二氧化氮与NO分离,再与氧气反应,最后要加尾气处理装置;
(2)根据NO易被氧化来分析;
(3)根据装置D中的反应来分析现象;
(4)氧气过量,则4NO2+O2+2H2O=4HNO3;
(5)利用硝酸与金属的化学反应方程式及极限法来分析.
解答 解:(1)因属与浓硝酸反应会生成二氧化氮,要验证NO的生成,则先冷却使二氧化氮与NO分离,则选择E装置,验证NO的存在,利用其与氧气反应生成红棕色气体,则选择D装置,氮的氧化物对环境有污染,不能排放在环境中,应利用碱处理尾气,则选择F装置,所选择仪器的连接顺序为E→D→F,
故答案为:E→D→F;
(2)因NO易被氧化,若装置中存在氧气则不能说明NO的存在,所以反应前先通入N2目的是排尽装置中的空气,防止NO被氧化,故答案为:排尽装置中的空气,防止NO被氧化;
(3)因NO与氧气反应生成二氧化氮,则观察到D中烧瓶内通入O2后,无色气体变成红棕色,
故答案为:D中烧瓶内通入O2后,无色气体变成红棕色;
(4)因氧气过量发生4NO2+O2+2H2O=4HNO3,硝酸与碱反应生成硝酸钠,整个过程的化学反应为4NO2+O2+4NaOH=4NaNO3,
故答案为:4NO2+O2+4NaOH=4NaNO3;
(5)由M+4HNO3═M(NO3)2+NO2↑+2H2O,只生成二氧化氮时,被还原硝酸的物质的量n为$\frac{a}{2}$mol,
由3M+8HNO3═3M(NO3)2+2NO↑+4H2O,只生成一氧化氮,被还原硝酸的物质的量n为$\frac{a}{4}$mol,
以上两个反应都发生,则被还原硝酸的物质的量$\frac{a}{4}$mol<n<$\frac{a}{2}$mol,故答案为:$\frac{a}{4}$mol<n<$\frac{a}{2}$mol.
点评 本题考查金属与硝酸的反应,明确装置的作用、物质的性质、温度对化学平衡的影响、极限法分析等即可解答,难度稍大.

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案| A. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| B. | 氯化亚铁溶液和稀硝酸混合:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| C. | AlCl3溶液中加入足量的氨水:Al3++4OH-═AlO2-+2H2O | |
| D. | NO2溶于水:3NO2+H2O═2H++2NO3-+NO |
| A. | 光纤的主要成分是高纯度的单质硅 | |
| B. | SiO2是酸性氧化物,它不溶于水也不溶于任何酸 | |
| C. | 因高温时SiO2与Na2CO3反应放出CO2,所以H2SiO3酸性比H2CO3强 | |
| D. | 28Si、29Si、30Si互为同位素 |
| A. | 对苯二甲酸 | B. | 丙酸 | C. | 乙二醇 | D. | 乙酸 |
①SO2 的物质的量不再变化
②O2 的浓度不再变化
③容器内气体压强不再变化
④混合气体的密度不再变化
⑤SO2 的生成速率和SO2 的分解速率相等
⑥SO2 的生成速率和O2 的消耗速率相等
⑦SO3的生成速率和SO3的分解速率相等
⑧混合气体的平均相对分子质量不再变化.
| A. | ①②③④ | B. | ④⑤⑥⑦ | C. | ①②③⑤⑦⑧ | D. | ①②⑤⑦ |
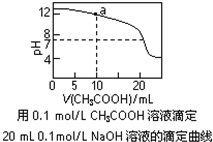
| A. | pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>① | |
| B. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| C. | 图中pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+) | |
| D. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
 (1)在实验室里制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计如图所示实验以确认上述混和气体中有C2H4和SO2. (乙烯的制取装置略)
(1)在实验室里制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计如图所示实验以确认上述混和气体中有C2H4和SO2. (乙烯的制取装置略)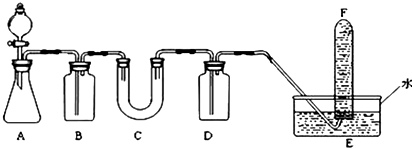
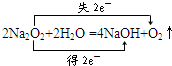 ,所以
,所以

 反应类型:加聚反应.
反应类型:加聚反应.