题目内容
11.已知乙烯能发生以下转化: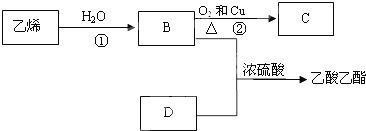
(1)乙烯的电子式为:

(2)写出反应的化学方程式
①CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH 反应类型:加成反应
②2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O 反应类型:氧化反应
③
 反应类型:加聚反应.
反应类型:加聚反应.
分析 乙烯与水发生加成反应生成B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应生成C为CH3CHO,B与D反应生成乙酸乙酯(CH3COOCH2CH3),则D为CH3COOH,据此解答.
(1)乙烯的分子式为C2H4,含有1个C=C键,据此写出乙烯的电子式;
(2)①乙烯与水发生加成反应生成乙醇;
②乙醇发生催化氧化反应生成乙醛,即B为乙醇,C为乙醛,D为乙酸;
③乙烯发生加聚反应得到聚乙烯.
解答 解:乙烯与水发生加成反应生成B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应生成C为CH3CHO,B与D反应生成乙酸乙酯(CH3COOCH2CH3),则D为CH3COOH,
(1)乙烯的电子式为 ,故答案为
,故答案为 ;
;
(2)①乙烯和水之间发生加成反应可以生成乙醇,即CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,反应类型为加成反应;
②乙醇可被催化氧化为乙醛,即2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,反应类型为氧化反应;
③乙烯发生加聚反应得到聚乙烯,即 ,反应类型为加聚反应.
,反应类型为加聚反应.
故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,加成反应;2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,氧化反应; ,加聚反应;
,加聚反应;
点评 本题主要考查了有机物的化学性质和化学方程式的书写,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
4.一定温度下,反应N2(g)+3H2(g)═2NH3(g)达到化学平衡状态的标志是( )
| A. | N2、H2、NH3的物质的量不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:2:3 | |
| C. | N2与H2物质的量之和是NH3的2倍 | |
| D. | 单位时间里每增加1mol N2,同时增加3mol H2 |
2.如图所示,X、Y分别是直流电源的两极,通电后后发生a极板质量增加,b极板处有无色无味气体放出.符合这一情况的是( )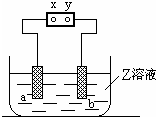

| a极板 | b极板 | X电极 | Z溶液 | |
| A | 石墨 | 石墨 | 正极 | NaOH |
| B | 铜 | 石墨 | 负极 | CuCl2 |
| C | 锌 | 石墨 | 负极 | CuSO4 |
| D | 银 | 铁 | 正极 | AgNO3 |
| A. | A | B. | B | C. | C | D. | D |
16.在一定条件下,可逆反应N2+3H2??2NH3(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是( )
| A. | 加催化剂,v正、v逆都发生变化,且变化的倍数相等 | |
| B. | 加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数 | |
| C. | 降温,v正、v逆减小,且v正减小的倍数大于v逆减小的倍数 | |
| D. | 体积不变,加入氩气,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数 |
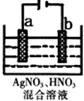
3.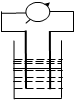 在如图所示装置中,观察到电流表指针偏转,M棒(左)变粗,N棒(右)变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
在如图所示装置中,观察到电流表指针偏转,M棒(左)变粗,N棒(右)变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
 在如图所示装置中,观察到电流表指针偏转,M棒(左)变粗,N棒(右)变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
在如图所示装置中,观察到电流表指针偏转,M棒(左)变粗,N棒(右)变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )| M | N | P | |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 铁 | 稀盐酸 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 铜 | 铁 | 硝酸铁溶液 |
| A. | A | B. | B | C. | C | D. | D |
20.下列实验装置设计与对应结论正确的是( )
| 选项 | A | B | C | D |
| 装置 |  | 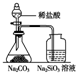 | 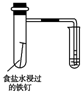 | 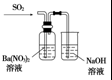 |
| 结论 | 能证明Al(OH)3不溶于氨水 | 能证明非金属性:Cl>C>Si | 验证铁发生析氢腐蚀 | 洗气瓶中产生的白色沉淀是BaSO3 |
| A. | A | B. | B | C. | C | D. | D |
1.新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列能源不属于新能源的是( )
| A. | 氢能 | B. | 煤 | C. | 太阳能 | D. | 生物质能 |
 化学反应原理在生活和工业中应用广泛.
化学反应原理在生活和工业中应用广泛.