题目内容
【题目】图A~K都是中学化学实验中使用的或能够制备的物质,已知A~K物质中部分是某二价金属元素X的化合物,有一些是含常见非金属元素Y的物质,且C、E、G、K是气体,物质间有如下反应关系: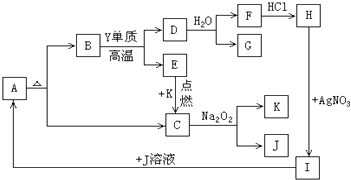
请填写:
(1)元素X的符号 , 元素Y的名称 .
(2)写出反应D→G+F的化学方程式 .
(3)写出反应C→K+J的化学方程式 .
(4)除I外,还有(填字母)能与J溶液反应生成A.
【答案】
(1)Ca;碳
(2)CaC2+2H2O→C2H2↑+Ca(OH)2
(3)2CO2+2Na2O2=2Na2CO3+O2
(4)B、F、H
【解析】解:C是气体,能与过氧化钠反应生成气体K和物质J,则可知C为CO2 , K为O2 , J为Na2CO3 , 气体E在氧气中点燃生成CO2 , 所以E为CO,非金属单质Y与B在高温下反应生成D和E,则Y应为C,B为应为二价金属元素X的化合物,根据A受热分解生成B和二氧化碳,可知A为CaCO3 , B为CaO,CaO与碳反应生成D为CaC2 , CaC2与水反应生成F为Ca(OH)2 , 气体G为C2H2 , F与氯化氢反应生成H为CaCl2 , CaCl2与硝酸银反应生成I为Ca(NO3)2 , I与Na2CO3反应生成碳酸钙,符合各物质的转化关系,(1)根据上面的分析可知,元素X为Ca,元素Y的名称为碳,所以答案是:Ca;碳;(2)CaC2与水反应生成Ca(OH)2和C2H2 , 反应的化学方程式为CaC2+2H2O→C2H2↑+Ca(OH)2 , 所以答案是:CaC2+2H2O→C2H2↑+Ca(OH)2;(3)反应C→K+J为二氧化碳与过氧化钠反应生成氧气和碳酸钠,反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2 , 所以答案是:2CO2+2Na2O2=2Na2CO3+O2;(4)J为Na2CO3 , 能与CaO、Ca(OH)2、CaCl2等反应生成CaCO3 , 所以答案是:B、F、H;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在③~⑦元素中,原子半径最大的是___________,其离子的原子结构示意图为___________
(2)①~⑩元素中,最高价氧化物对应的水化物中酸性最强的是________,碱性最强的是________,呈两性的氢氧化物是________;三者相互反应的离子方程为__________,__________,__________。
(3)元素②的一种原子质子数比中子数少1,则m克此种原子形成的简单离子中含有的电子数为______________mol。
(4)在⑦与⑩的单质中,化学性质较活泼的是___________,可用什么化学反应说明该事实(写出反应的化学方程式):___________________________________。
【题目】研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.下表是部分化学键的键能数据:
化学键 | P﹣P | P﹣O | O=O | P=O |
键能/kJmol﹣1 | 197 | 360 | 499 | X |
已知白磷的燃烧热为2378.0kJ/mol,白磷完全燃烧的产物结构如图所示,则上表中X=kJmol﹣1 . ( )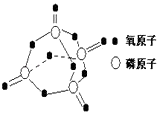
A.1057.5 kJmol﹣1
B.335.25 kJmol﹣1
C.433.75 kJmol﹣1
D.959.0 kJmol﹣1
【题目】印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2 . 下表是25℃时HClO2 及几种常见弱酸的电离平衡常数:
弱酸 | HClO2 | HF | HCN | H2S |
Ka | 1×10﹣2 | 6.3×10﹣4 | 4.9×10﹣10 | K1=9.1×10﹣8K2=1.1×10﹣12 |
(1)常温下,物质的量浓度相等的①NaClO2、②NaF、③NaCN、④Na2S四种溶液的pH由大到小的顺序为;体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:(填“前者大”“相等”或“后者大”).
(2)Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+ 离子,滴加Na2S溶液后首先析出的沉淀是;当最后一种离子沉淀完全时(该离子浓度为10﹣5molL﹣1)此时的S2﹣的浓度为 .
已知Ksp(FeS)=6.3×10﹣18(molL﹣1)2 , Ksp(CuS)=6×10﹣36(molL﹣1)2 , Ksp(PbS)=2.4×10﹣28(molL﹣1)2 .
