题目内容
【题目】印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2 . 下表是25℃时HClO2 及几种常见弱酸的电离平衡常数:
弱酸 | HClO2 | HF | HCN | H2S |
Ka | 1×10﹣2 | 6.3×10﹣4 | 4.9×10﹣10 | K1=9.1×10﹣8K2=1.1×10﹣12 |
(1)常温下,物质的量浓度相等的①NaClO2、②NaF、③NaCN、④Na2S四种溶液的pH由大到小的顺序为;体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:(填“前者大”“相等”或“后者大”).
(2)Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+ 离子,滴加Na2S溶液后首先析出的沉淀是;当最后一种离子沉淀完全时(该离子浓度为10﹣5molL﹣1)此时的S2﹣的浓度为 .
已知Ksp(FeS)=6.3×10﹣18(molL﹣1)2 , Ksp(CuS)=6×10﹣36(molL﹣1)2 , Ksp(PbS)=2.4×10﹣28(molL﹣1)2 .
【答案】
(1)pH(Na2S)>pH(NaCN)>pH(NaF)>pH(NaClO2);前者大
(2)CuS;6.3×10﹣13
【解析】解(1)根据电离平衡常数可知酸性强弱顺序为:HClO2>HF>HCN>HS﹣ , 酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大,故物质的量浓度相等各溶液pH关系为:pH(Na2S)>pH(NaCN)>pH(NaF)>pH(NaClO2),NaF、NaCN两溶液中钠离子浓度相同,由于阴离子都是﹣1价离子,1mol阴离子水解得到1mol氢氧根离子,阴离子的总浓度不变,两溶液中阴离子总浓度相同,溶液为碱性,pH(NaCN)>pH(NaF),故NaCN溶液碱氢离子浓度较小,含有阴阳离子总数较小,即NaF溶液中阴阳离子总数较大,所以答案是:pH(Na2S)>pH(NaCN)>pH(NaF)>pH(NaClO2);前者大;(2)物质组成类型相同,溶度积越小,溶解度越小,滴加硫化钠,相应阳离子最先沉淀,故首先析出沉淀是CuS,Fe2+最后沉淀,沉淀完全时该浓度为10﹣5molL﹣1 , 此时的S2﹣的浓度为 ![]() mol/L=6.3×10﹣13mol/L,所以答案是:CuS;6.3×10﹣13mol/L.
mol/L=6.3×10﹣13mol/L,所以答案是:CuS;6.3×10﹣13mol/L.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
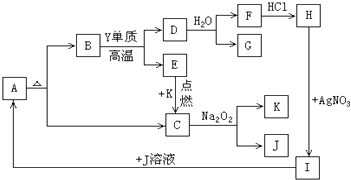
课课优能力培优100分系列答案【题目】四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题.
W | X | Y | Z | |
结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
(1)Z在元素周期表中位于族.
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是(填元素符号).
(3)①下列可作为比较X和Y金属性强弱的依据是(填序号).a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因: .
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是 , 混合后溶液中离子浓度由大到小的顺序是 .
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.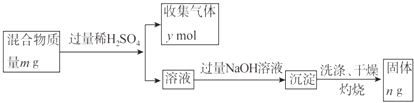
能确定混合物中Y的质量分数的数据有(填序号).
a.m、n b.m、y c.n、y.