题目内容
14.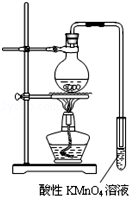 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.实验原理:CH3CH2Br+NaOH $→_{△}^{醇}$CH2=CH2↑+NaBr+H2O
实验过程:组装如图所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象.一段时间后,观察到酸性KMnO4溶液颜色褪去.
(1)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因:乙醇易挥发,挥发出来的乙醇也可以使酸性KMnO4溶液褪色;改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显.该小组再次查阅资料,对实验进行进一步的改进.
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%.
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快.
资料三:溴乙烷的沸点:38.2℃.
(2)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是反应温度较低,此时发生反应的化学方程式为:CH3CH2Br+NaOH$→_{△}^{H_{2}O}$CH3CH2OH+NaBr.
(3)结合资料二、三,你认为还应该在实验装置中增加的两种仪器是①冷凝管(或者用较长的导气管) ②量程为200℃温度计.
分析 (1)从反应装置出来的气体除了生成的乙烯外还有挥发出来的乙醇,所以使酸性KMnO4溶液颜色褪去不一定是产生的乙烯在作用;
(2)根据改进实验装置后,溶液颜色褪色不明显,说明生成的乙烯量很少,结合资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%不难分析原因;
(3)根据资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快,说明要产生乙烯要控制温度在90℃~110℃,所以需要一个量程为200℃温度计,再根据资料三:溴乙烷的沸点:38.2℃,所以在制得的乙烯中会含有溴乙烷气体的杂质,需要冷凝除去,所以需要冷凝管.
解答 解:(1)因为乙醇具有挥发性,所以从反应装置出来的气体除了生成的乙烯外还有挥发出来的乙醇,乙烯和乙醇都可以使酸性KMnO4溶液颜色褪去,故不一定是产生的乙烯,
故答案为:乙醇易挥发,挥发出来的乙醇也可以使酸性KMnO4溶液褪色;
(2)根据改进实验装置后,溶液颜色褪色不明显,说明生成的乙烯量很少,结合资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%,所以应该是反应温度较低主要发生了取代反应,方程式为:CH3CH2Br+NaOH$→_{△}^{H_{2}O}$CH3CH2OH+NaBr,
故答案为:反应温度较低;CH3CH2Br+NaOH$→_{△}^{H_{2}O}$CH3CH2OH+NaBr;
(3)根据资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快,说明要产生乙烯要控制温度在90℃~110℃,所以需要一个量程为200℃温度计,再根据资料三:溴乙烷的沸点:38.2℃,所以在制得的乙烯中会含有溴乙烷气体的杂质,需要冷凝除去,所以需要冷凝管,
故答案为:冷凝管(或者用较长的导气管),量程为200℃温度计.
点评 本题主要考查探究溴乙烷的消去反应的条件并验证产物,关键培养学生提取信息的能力,并利用好这些信息来设计好实验,难度中等.

| A. | 1:1:1 | B. | 3:1:2 | C. | 6:2:3 | D. | 18:3:4 |
 ,下列叙述中不正确的是( )
,下列叙述中不正确的是( )| A. | 1mol胡椒酚最多可与4mol氢气发生反应 | |
| B. | 1mol胡椒酚最多可与3mol溴水发生反应 | |
| C. | 胡椒酚所有原子可能共面 | |
| D. | 胡椒酚在水中的溶解度小于苯酚在水中的溶解度 |
| A. | 硝基苯和水 | B. | 苯和高锰酸钾溶液 | ||
| C. | 甘油和水 | D. | 溴苯和NaOH溶液 |
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 6 | 0.2 | 5 | 0.2 | 9 |
| C | 35 | 8 | 0.15 | 10 | 0.1 | 2 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
| A. | A | B. | B | C. | C | D. | D |
| A. | FeCl2 | B. | H2S | C. | S | D. | HCl |
| A. | HCl→H2 | B. | HCl→FeCl2 | C. | Fe→Fe2O3 | D. | H2SO4(浓)→SO2 |
| A. | 在含大量Fe3+的溶液中:NH${\;}_{4}^{+}$、Na+、Cl-、SCN- | |
| B. | 在含有Al3+、Cl-的溶液中:HCO${\;}_{3}^{-}$、I-、NH${\;}_{4}^{+}$、Mg2+ | |
| C. | 在溶质为KNO3和NaHSO4的溶液中:Fe2+、Ca2+、Al3+、Cl- | |
| D. | 常温下,在c(H+)=1×10-13mol•L-1的溶液中:Na+、S2-、SO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$ |