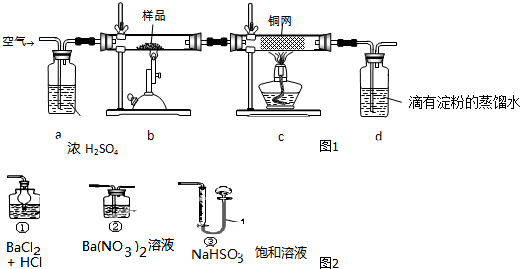
题目内容
9.下列各组混合物不能用分液漏斗分离的是( )| A. | 硝基苯和水 | B. | 苯和高锰酸钾溶液 | ||
| C. | 甘油和水 | D. | 溴苯和NaOH溶液 |
分析 根据分液漏斗可以将互不相溶的两层液体分开,则分析选项中物质的溶解性即可.
解答 解:A.硝基苯和水不溶,能用分液漏斗进行分离,故A错误;
B.苯和高锰酸钾溶液不溶,能用分液漏斗进行分离,故B错误;
C.甘油和水互溶,不能用分液漏斗进行分离,故C正确;
D.溴苯和NaOH溶液不溶,能用分液漏斗进行分离,故D错误.
故选C.
点评 本题考查了物质的分离和提纯,难度不大,注意分液漏斗能分离的物质必须是互不相溶的液体.

练习册系列答案
相关题目
1.常温下,将少量的下列固体物质投入对应的溶液中,溶液显红色的是( )
| 选项 | 固体 | 溶液 |
| A | 钠 | 含酚酞的氯化钠溶液 |
| B | 铁 | 含紫色石蕊试液的氯化钠溶液 |
| C | 铜 | 含紫色石蕊试液的氯化钠溶液 |
| D | 铝 | 含酚酞的氯化钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
17.下列关于卤素的叙述说法正确的是( )
| A. | 单质的颜色随核电荷数的增加逐渐加深 | |
| B. | 元素的最高化合价均为+7 | |
| C. | 从上到下原子半径递减 | |
| D. | 从上到下非金属的活拨性减弱 |
18. 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
(1)D的离子结构示意图是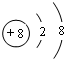 ;化合物Y所含的化学键名称离子键、共价键;B2C2的电子式表示为
;化合物Y所含的化学键名称离子键、共价键;B2C2的电子式表示为 .
.
(2)D、E、F的简单离子半径由大到小的顺序是(用化学式表示)S2->Cl->Al3+.
(3)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式H++HSO3-=SO2↑+H2O.
(4)将一定质量的Mg和D的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则固体混合物中Mg的质量为3.6g;原稀硫酸溶液的物质的量浓度为1mol/L.
 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
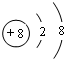 ;化合物Y所含的化学键名称离子键、共价键;B2C2的电子式表示为
;化合物Y所含的化学键名称离子键、共价键;B2C2的电子式表示为 .
.(2)D、E、F的简单离子半径由大到小的顺序是(用化学式表示)S2->Cl->Al3+.
(3)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式H++HSO3-=SO2↑+H2O.
(4)将一定质量的Mg和D的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则固体混合物中Mg的质量为3.6g;原稀硫酸溶液的物质的量浓度为1mol/L.
19.下列说法正确的是( )
| A. | 相对分子质量越大的分子组成的物质,其熔沸点越高 | |
| B. | 在相同物质的量的情况下,多元酸溶液的酸性都比一元酸溶液强 | |
| C. | 在复分解反应中弱酸也可以生成强酸 | |
| D. | 同一元素,价态越高,氧化性肯定越强 |
 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.