题目内容
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
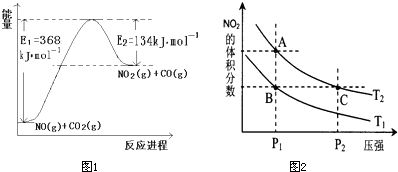
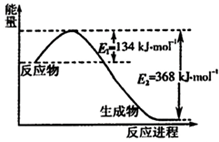
(1)如图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(图中涉及物质均为气态),请写出NO2和CO反应的热化学方程式
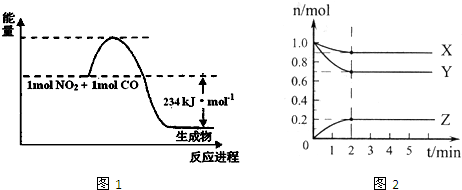
(2)在0.5L的密闭容器中,充入一定量的氮气和氢气进行反应,三种气体的物质的量随时间的变化曲线如图2所示.则Y是
(3)硝酸工业在国民经济、国防工业和航天事业中占有重要地位.随着化学纤维、近代有机合成、火箭、导弹等工业的迅速发展,需要使用大量的硝酸.
①工业生产中用铂系金属作为催化剂,用氨氧化法制取硝酸.第一步反应为氨在催化剂作用下与氧气发生反应生成NO,写出反应化学方程式
②铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平).反应中还原产物是
(1)如图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(图中涉及物质均为气态),请写出NO2和CO反应的热化学方程式
NO2(g)+CO(g)=CO2(g)+NO(g);△H=-234kJ?mol-1
NO2(g)+CO(g)=CO2(g)+NO(g);△H=-234kJ?mol-1
.(2)在0.5L的密闭容器中,充入一定量的氮气和氢气进行反应,三种气体的物质的量随时间的变化曲线如图2所示.则Y是
H2
H2
,2min内N2的反应速率υ(N2)=0.1mol?L-1?min-1
0.1mol?L-1?min-1
.
(3)硝酸工业在国民经济、国防工业和航天事业中占有重要地位.随着化学纤维、近代有机合成、火箭、导弹等工业的迅速发展,需要使用大量的硝酸.
①工业生产中用铂系金属作为催化剂,用氨氧化法制取硝酸.第一步反应为氨在催化剂作用下与氧气发生反应生成NO,写出反应化学方程式
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
②铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平).反应中还原产物是
NO和NO2
NO和NO2
,0.6mol Cu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则得到标准状况下气体体积为13.44
13.44
L.分析:(1)先求出此反应的焓变,根据热化学方程式的书写规则再写出热化学方程式;
(2)根据氮气和氢气的反应之比,可知Y为氢气;根据化学反应速率计算公式分析;
(3)制备硝酸的第一步反应是氨的催化氧化生成一氧化氮和水;根据化合价分析还原产物;根据电子守恒求出气体的体积.
(2)根据氮气和氢气的反应之比,可知Y为氢气;根据化学反应速率计算公式分析;
(3)制备硝酸的第一步反应是氨的催化氧化生成一氧化氮和水;根据化合价分析还原产物;根据电子守恒求出气体的体积.
解答:解:(1)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1;
(2)根据氮气和氢气的反应之比,可知Y为氢气;2min内N2的反应速率υ(N2)=
=
=0.1mol?L-1?min-1;故答案为:H2、0.1mol?L-1?min-1;
(3)制备硝酸的第一步反应是氨的催化氧化生成一氧化氮和水,即4NH3+5O2
4NO+6H2O;硝酸中的氮元素化合价降低,故NO、NO2为还原产物;如果得到的NO和NO2物质的量相同,假设均为1mol,则氮元素的电子数为4.所以一参加反应的铜的物质的量为2mol,0.6mol Cu被硝酸完全溶解后,会生成0.3mol的一氧化氮和0.3mol二氧化氮,则得到标准状况下气体体积为22.4L/mol×0.6mol=13.44L;故答案为:①4NH3+5O2
4NO+6H2O,②NO和NO2、13.44.
(2)根据氮气和氢气的反应之比,可知Y为氢气;2min内N2的反应速率υ(N2)=
| △c |
| △t |
| 0.1mol |
| 0.5L×2min |
(3)制备硝酸的第一步反应是氨的催化氧化生成一氧化氮和水,即4NH3+5O2
| ||
| △ |
| ||
| △ |
点评:本题考查热化学方程式的书写,根据反应物和生成物总能量的大小求出反应热.

练习册系列答案
相关题目
 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.