题目内容
【题目】在MgCl2和AlCl3的混合液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如图所示。
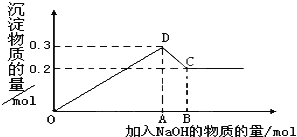
(1)写出下列线段内发生反应的方程式:
OD段__________________________________。
CD段__________________________________。
(2)图中C点表示加入________mol NaOH时。
(3)原溶液中来自MgCl2、AlCl3 的氯离子物质的量浓度之比为_____________。
(4)图中线段OB:OA=_________。
【答案】 Al3+ + 3OH- = Al(OH)3↓、Mg2++ 2OH-= Mg(OH)2↓ Al(OH)3 + OH- = AlO2-+2H2O 0.8 2:1 8:7
【解析】(1)向MgCl2和AlCl3的混合液中,逐滴加入NaOH溶液直至过量,其中OD发生Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓,DC发生Al(OH)3+OH-=AlO2-+2H2O;(2)沉淀量最大时加入的氢氧化钠n(NaOH)=2n[Mg(OH)2]+3n[Al(OH)3]=2×0.2mol+3×0.1mol=0.7mol,Al(OH)3+OH-=AlO2-+2H2O中消耗NaOH为0.1mol,则C点时NaOH为0.8mol,图中C点表示加入0.8molNaOH;(3)由图可知,氢氧化铝的物质的量为0.3mol-0.2mol=0.1mol,则氢氧化镁为0.2mol,结合原子守恒可知原溶液中Mg2+、Al3+的物质的量浓度之比为0.2:0.1=2:1;(4)由(2)可知,图中线段OB:OA=0.8mol:0.7mol=8:7。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案