题目内容
【题目】下列热化学方程式正确的是( )
A.甲烷的标准燃烧热为890.3 kJ?mol﹣1 , 则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3 kJ?mol﹣1
B.已知:H2(g)+ ![]() O2(g)=H2O(g)△H=﹣Q1kJ/mol,则2H2O(l)=2H2(g)+O2(g)△H=﹣2Q1kJ/mol
O2(g)=H2O(g)△H=﹣Q1kJ/mol,则2H2O(l)=2H2(g)+O2(g)△H=﹣2Q1kJ/mol
C.已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量,其热化学方程式为
N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣641.6 kJ?mol﹣1
D.已知:强酸和强碱的稀溶液中和热可表示为:H+(aq)+OH﹣(aq)?H2O(l)
△H=﹣57.3kJ/mol,则H2SO4(aq)+Ba(OH)2(aq)=BaSO4(aq)+2H2O(l)△H=﹣114.6kJ/mol
【答案】C
【解析】解:A.甲烷燃烧热是1mol甲烷完全燃烧生成稳定氧化物放出的热量,热化学方程式中水是气体,正确的热化学方程式为:甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890.3 kJmol﹣1 , 故A错误;
B.已知H2(g)+ ![]() O2(g)=H2O(g)△H=﹣Q1kJ/mol,若生成1mol液态水时放出的热量会大于Q1kJ,则2H2O(l)=2H2(g)+O2(g)△H>2Q1kJ/mol,故B错误;
O2(g)=H2O(g)△H=﹣Q1kJ/mol,若生成1mol液态水时放出的热量会大于Q1kJ,则2H2O(l)=2H2(g)+O2(g)△H>2Q1kJ/mol,故B错误;
C.1 g液态肼的物质的量为: ![]() =
= ![]() mol,则1mol液态肼完全反应放出的热量为:20.05 kJ×
mol,则1mol液态肼完全反应放出的热量为:20.05 kJ× ![]() =641.6kJ,该反应的化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣641.6 kJmol﹣1 , 故C正确;
=641.6kJ,该反应的化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣641.6 kJmol﹣1 , 故C正确;
D.强酸强碱的中和热为﹣57.3 kJ/mol,而Ba(OH)2(aq)+H2SO4(aq)=BaSO4(S)+2H2O(l)反应过程包括中和热和沉淀热,△H不是114.6 kJ,故D错误;
故选C.
【考点精析】认真审题,首先需要了解反应热和焓变(在化学反应中放出或吸收的热量,通常叫反应热).

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测.某工厂对制铬工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸液中金属离子主要是Cr3+ , 其次是Fe3+ , Fe2+ , Al3+ , Ca2+ , Mg2+) 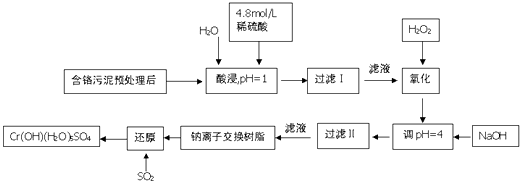
常温下部分阳离子的氢氧化物形成沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | ﹣ |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是(至少一条)
(2)调pH=4.0是为了除去(填Fe3+ , Al3+ , Ca2+ , Mg2+)
(3)钠离子交换树脂的原理为Mn++n NaR→MRn+nNa+ , 被交换的杂质离子是(填Fe3+ , Al3+ , Ca2+ , Mg2+)
(4)试配平下列氧化还原反应方程式:Na2Cr2O7+SO2+H2O=Cr(OH)(H2O)5SO4+Na2SO4 .