题目内容
【题目】某化学小组设计如图装置,探究铜和一定量的浓HNO3是否反应是否有NO生成.已知:A试管内空气体积为50mL(标准状况),B广口瓶盛80mL水,硝酸不溶于煤油. 请回答下列问题: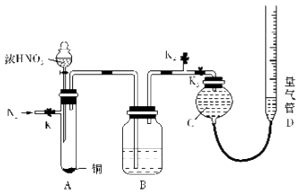
(1)加入浓HNO3前应先通一段时间N2 , 具体操作为: , 其作用是 .
(2)关闭K1、K2 , 打开K3 , 通过分液漏斗向试管中加入一定量的浓硝酸,然后在硝酸上方加一层煤油,煤油的作用是 , 待铜和硝酸反应完毕后,通过分液漏斗向试管中加煤油直至试管充满.
(3)读取量气管读数时,要先 , 然后再读取读数.
(4)数据分析:①从B中取20mL溶液,恰好中和用去0.lmol/L的NaOH体积为16mL则B中所得硝酸的物质的量浓度为 . ②假设只生成NO2 , 通过计算理论上收集到的气体体积为mL (标准状况下).
③实验最终测得气体的体积为130.5mL(标准状况下),与理论值有差异,其理由可能为 .
A.Cu与一定物质的量浓度的HNO3反反应除了生成NO2还生成NO
B.过程中还发生了反应4NO+3O2+2H2O=4HNO3
C.过程中还发生了反应4NO2+O2+2H2O=4HNO3
D.硝酸具有挥发性,对实验有影响.
【答案】
(1)关闭K3,打开K1、K2通入N2 ;排尽装置内的空气,以防氧化可能生成的NO
(2)液封,防正硝酸挥发
(3)向下移动量气管D,调整液面使C、D 中液面相平
(4)0.08mol/L;121.68; A
【解析】解:(1)由装置图可知N2从K3进,空气从K1排出,所以要关闭 K2,打开K1、K3;NO易被空气中的氧气氧化,所以要先用氮气排净装置中的空气;所以答案是:关闭K3,打开K1、K2;排尽装置内的空气,以防氧化可能生成的NO;(2)硝酸属于挥发性酸,煤油的密度小在硝酸上面,能防止硝酸挥发,所以在硝酸中加煤油的作用为液封,防正硝酸挥发;所以答案是:液封,防正硝酸挥发;(3)读数时要保持左右气体压强相等,以减少误差,即保持两边液面相平,还要用眼睛平视读数,即向下移动量气管D,调整液面使C、D 中液面相平;所以答案是:向下移动量气管D,调整液面使C、D 中液面相平;(4)①B中溶液为硝酸,与氢氧化钠等物质的量反应,从B中取20mL溶液,恰好中和用去0.lmol/L的NaOH体积为16mL,则c(硝酸)= ![]() =0.08mol/L;所以答案是:0.08mol/L;②B中发生的反应为3NO2+H2O=2HNO3+NO,B中溶液的体积为80mL,则B中硝酸的物质的量为0.08L×0.08mol/L=0.0064mol,所以NO的体积为0.0064mol×
=0.08mol/L;所以答案是:0.08mol/L;②B中发生的反应为3NO2+H2O=2HNO3+NO,B中溶液的体积为80mL,则B中硝酸的物质的量为0.08L×0.08mol/L=0.0064mol,所以NO的体积为0.0064mol× ![]() ×22.4L/mol=0.07168L,由于A中残留N2为50mL,也被全部排到量气管中,所以理论上收集到的气体体积为71.68+50=121.68mL;所以答案是:121.68;③A.Cu与一定物质的量浓度的HNO3反反应除了生成NO2还生成NO,生成NO时,量气管中NO偏多,实验最终测得气体的体积为130.5mL比理论值偏大,故A正确;B.过程中还发生了反应4NO+3O2+2H2O=4HNO3,则量气管中NO偏少,而实验最终测得气体的体积为130.5mL比理论值偏大,故B错误;C.过程中还发生了反应4NO2+O2+2H2O=4HNO3,则量气管中NO偏少,实验最终测得气体的体积为130.5mL比理论值偏大,故C错误;D.实验中加了煤油,排除了硝酸挥发性的影响,实验值与理论值相近,故D错误;所以答案是:A.
×22.4L/mol=0.07168L,由于A中残留N2为50mL,也被全部排到量气管中,所以理论上收集到的气体体积为71.68+50=121.68mL;所以答案是:121.68;③A.Cu与一定物质的量浓度的HNO3反反应除了生成NO2还生成NO,生成NO时,量气管中NO偏多,实验最终测得气体的体积为130.5mL比理论值偏大,故A正确;B.过程中还发生了反应4NO+3O2+2H2O=4HNO3,则量气管中NO偏少,而实验最终测得气体的体积为130.5mL比理论值偏大,故B错误;C.过程中还发生了反应4NO2+O2+2H2O=4HNO3,则量气管中NO偏少,实验最终测得气体的体积为130.5mL比理论值偏大,故C错误;D.实验中加了煤油,排除了硝酸挥发性的影响,实验值与理论值相近,故D错误;所以答案是:A.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案