题目内容
10.以CO2为碳源制取低碳有机物一直是化学领域的研究热点,CO2加氢制取低碳醇的反应如下:反应Ⅰ:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0kJ/mol
反应Ⅱ:2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g)△H=-173.6kJ/mol
写出由CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式(另一产物为水蒸气)2CH3OH(g)=CH3CH2OH(g)+H2O(g)△H=-75.6kJ/mol.
分析 依据热化学方程式和盖斯定律计算得到所需热化学方程式,根据盖斯定律Ⅱ-I×2得到.
解答 解:由反应I:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0 kJ•mol-1
反应II:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-173.6kJ•mol-1
根据盖斯定律Ⅱ-I×2得:2CH3OH(g)=CH3CH2OH(g)+H2O(g)△H=-75.6 kJ•mol-1;
故答案为:2CH3OH(g)=CH3CH2OH(g)+H2O(g)△H=-75.6 kJ•mol-1.
点评 本题考查热化学方程式的书写以及盖斯定律的应用,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握计算的思路,难度不大.

练习册系列答案
相关题目
5. 天然气、可燃冰的主要成分都是甲烷,甲烷既是一种清洁能源,又是一种重要的化工原料.
天然气、可燃冰的主要成分都是甲烷,甲烷既是一种清洁能源,又是一种重要的化工原料.
(1)以甲烷为主要原料可以生成合成气(CO和H2),主要反应如下:有研究认为甲烷部分氧化的机理为:
①CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ•mol-1
②CO(g)+H2O(g)═H2(g)+CO2(g);△H=-41.2kJ•mol-1
③2CO(g)+O2(g)═2CO2(g);△H=-566.0kJ•mol-1
则反应CH4(g)+CO2(g)═2CO(g)+2H2(g)的△H=+247.3kJ/mol.
(2)CH4也可以和H2O(g)在催化剂表面反应生成合成气:CH4(g)+H2O(g)═3H2(g)+CO(g),该反应在不同温度下的化学平衡常数K如下表:
(1)该反应△H>0(选填“>”或“<”);
(2)已知800℃时,向1L密闭容器中投入0.5molCH4、0.5mol H2O、0.5molH2和0.5molCO,则平衡时向正向移动(选填“正向移动”、“逆向移动”或“不移动”.
(3)工业上利用合成气在恒容、催化剂和加热的条件下可以生产甲醇,其热化学方程式为:2H2(g)+CO(g)═CH3OH(g)△H=-90.8kJ/mol.
①以下各项能说明该反应达到平衡状态的是AB.
A、混合气体的平均式量保持不变
B、混合气体的压强不变
C、混合气体的密度保持不变
D、2v逆(H2)=v正(CH3OH)
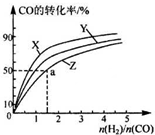
②在200℃、230℃和260℃三种不同温度、2L恒容密闭容器中研究合成甲醇的规律,如图是上述三种温度下不同的H2和C0的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线Z对应的温度是260℃.由起始达到 a 点所需时间为 5min,则 H2的反应速率 为0.1mol/(L•min).
(4)以熔融Li2CO3和K2CO3为电解质,向一极通入甲烷,另一极通入空气和CO2,甲烷可形成燃料电池.负极的电极反应式为CH4-8e-+4CO32-=5CO2+2H2O,若该装置的电流强度为1.6A,理论上每分钟应向负极通入标准状况下的气体约为2.8mL.(已知:一个电子所带电量为1.6×10-19C)
 天然气、可燃冰的主要成分都是甲烷,甲烷既是一种清洁能源,又是一种重要的化工原料.
天然气、可燃冰的主要成分都是甲烷,甲烷既是一种清洁能源,又是一种重要的化工原料.(1)以甲烷为主要原料可以生成合成气(CO和H2),主要反应如下:有研究认为甲烷部分氧化的机理为:
①CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ•mol-1
②CO(g)+H2O(g)═H2(g)+CO2(g);△H=-41.2kJ•mol-1
③2CO(g)+O2(g)═2CO2(g);△H=-566.0kJ•mol-1
则反应CH4(g)+CO2(g)═2CO(g)+2H2(g)的△H=+247.3kJ/mol.
(2)CH4也可以和H2O(g)在催化剂表面反应生成合成气:CH4(g)+H2O(g)═3H2(g)+CO(g),该反应在不同温度下的化学平衡常数K如下表:
| 温度(℃) | 800 | 1000 | 1200 | 1400 |
| 平衡常数(K) | 0.45 | 1.92 | 276.5 | 1771.5 |
(2)已知800℃时,向1L密闭容器中投入0.5molCH4、0.5mol H2O、0.5molH2和0.5molCO,则平衡时向正向移动(选填“正向移动”、“逆向移动”或“不移动”.
(3)工业上利用合成气在恒容、催化剂和加热的条件下可以生产甲醇,其热化学方程式为:2H2(g)+CO(g)═CH3OH(g)△H=-90.8kJ/mol.
①以下各项能说明该反应达到平衡状态的是AB.
A、混合气体的平均式量保持不变
B、混合气体的压强不变
C、混合气体的密度保持不变
D、2v逆(H2)=v正(CH3OH)
②在200℃、230℃和260℃三种不同温度、2L恒容密闭容器中研究合成甲醇的规律,如图是上述三种温度下不同的H2和C0的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线Z对应的温度是260℃.由起始达到 a 点所需时间为 5min,则 H2的反应速率 为0.1mol/(L•min).
(4)以熔融Li2CO3和K2CO3为电解质,向一极通入甲烷,另一极通入空气和CO2,甲烷可形成燃料电池.负极的电极反应式为CH4-8e-+4CO32-=5CO2+2H2O,若该装置的电流强度为1.6A,理论上每分钟应向负极通入标准状况下的气体约为2.8mL.(已知:一个电子所带电量为1.6×10-19C)
15.物质分类中,前者包含后者的是( )
| A. | 化合物 电解质 | B. | 化合物 胶体 | C. | 溶液 浊液 | D. | 溶液 分散系 |
2.把铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是( )
| A. | Fe2(SO4)3 | B. | 稀硫酸 | C. | AgNO3溶液 | D. | CuSO4 溶液 |
19.X、Y、Z、M、N代表五种金属.有以下化学反应:
①水溶液中:X+Y2+═X2++Y
②Z+2H2O(冷)═Z(OH)2+H2↑
③M、N为电极与N盐溶液组成原电池,发生的电极反应为:M-2e-═M2+
④Y可以溶于稀H2SO4中,M不被稀H2SO4氧化,则这五种金属的活泼性由弱到强的顺序是( )
①水溶液中:X+Y2+═X2++Y
②Z+2H2O(冷)═Z(OH)2+H2↑
③M、N为电极与N盐溶液组成原电池,发生的电极反应为:M-2e-═M2+
④Y可以溶于稀H2SO4中,M不被稀H2SO4氧化,则这五种金属的活泼性由弱到强的顺序是( )
| A. | M<N<Y<X<Z | B. | N<M<X<Y<Z | C. | N<M<Y<X<Z | D. | X<Z<N<M<Y |
20.下列离子方程式书写正确的是( )
| A. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | 将氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O | |
| C. | 铝片与氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑ | |
| D. | NaHCO3溶液中加入盐酸:CO32-+2H+=H2O+CO2↑ |


 ,
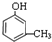
,
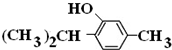 +3H2$→_{△}^{Ni}$
+3H2$→_{△}^{Ni}$
 ;.
;.

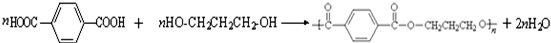 .
. ,请你设计出合理的反应流程图.
,请你设计出合理的反应流程图.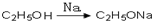 、
、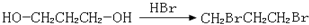 、
、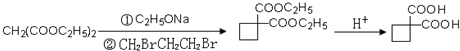 .
.