题目内容
19.X、Y、Z、M、N代表五种金属.有以下化学反应:①水溶液中:X+Y2+═X2++Y
②Z+2H2O(冷)═Z(OH)2+H2↑
③M、N为电极与N盐溶液组成原电池,发生的电极反应为:M-2e-═M2+
④Y可以溶于稀H2SO4中,M不被稀H2SO4氧化,则这五种金属的活泼性由弱到强的顺序是( )
| A. | M<N<Y<X<Z | B. | N<M<X<Y<Z | C. | N<M<Y<X<Z | D. | X<Z<N<M<Y |
分析 金属的金属性越强,其单质的还原性越强;在原电池中,一般来说,较活泼金属作负极、较不活泼金属作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应;在金属活动性顺序表中,位于氢之前的金属能置换出酸中的氢,据此分析解答.
解答 解:金属的金属性越强,其单质的还原性越强;在原电池中,一般来说,较活泼金属作负极、较不活泼金属作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应;在金属活动性顺序表中,位于氢之前的金属能置换出酸中的氢,
①水溶液中X+Y2+═X2++Y,说明活动性X>Y;
②Z+2H2O(冷水)═Z(OH)2+H2↑,能与冷水反应生成氢气说明Z金属性活动性很强;
③M、N为电极,与N盐溶液组成原电池,M电极反应为M-2e-═M2+,M失电子发生氧化反应,则M是负极、N是正极,活动性M>N;
④Y可以溶于稀硫酸中,M不被稀硫酸氧化,说明活动性Y>M,
通过以上分析知,金属活动性顺序N<M<Y<X<Z,
故选C.
点评 本题考查金属活动性强弱顺序判断,为高频考点,利用金属与酸或水反应置换出氢气难易程度、金属最高价氧化物的水化物碱性强弱、金属之间的置换反应等可以判断金属性强弱,注意不能根据失电子多少判断,为易错点,题目难度中等.

练习册系列答案
相关题目
9.下列情况一定能使反应速率加快的方法是( )
①升温 ②改变反应物浓度 ③增加生成物浓度 ④加压.
①升温 ②改变反应物浓度 ③增加生成物浓度 ④加压.
| A. | ①②③ | B. | ①③ | C. | ②③ | D. | ①②③④ |
4.已知某溶液中存在OH-、H+、NH4+、Cl-4种离子经4位同学测定其浓度大小关系如下,其中不可能正确的是( )
| A. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | B. | c(Cl-)>c(H+)>c(NH4+)>c(OH-) | ||
| C. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | D. | c(OH-)>c(H+)>c(Cl-)>c(NH4+) |
11.下列物质不能用于自来水消毒的是( )
| A. | SO2 | B. | Cl2 | C. | ClO2 | D. | O3 |
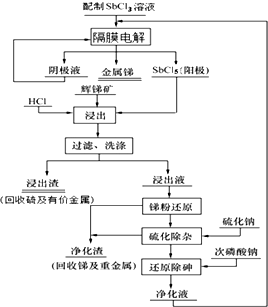 我国锑的蕴藏量占世界第一位.某课题组电解三氯化锑水溶液,利用阳极生成的五氯化锑作为浸出剂,对辉锑矿(Sb2S3)进行酸性浸出;从而实现浸出-电解的闭路循环,解决了传统炼锑过程中“工业三废”排放量大的问题.流程如图:
我国锑的蕴藏量占世界第一位.某课题组电解三氯化锑水溶液,利用阳极生成的五氯化锑作为浸出剂,对辉锑矿(Sb2S3)进行酸性浸出;从而实现浸出-电解的闭路循环,解决了传统炼锑过程中“工业三废”排放量大的问题.流程如图: