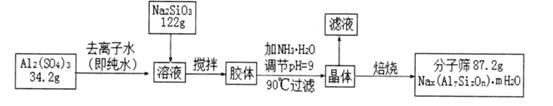
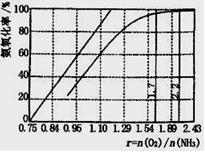
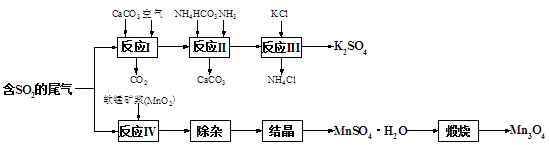
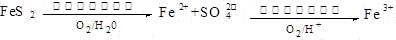题目内容
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
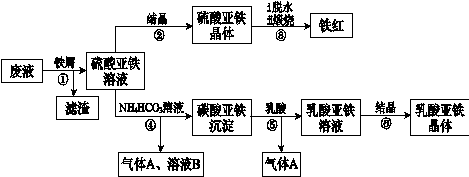
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是 。
步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、 。
(1)步骤④的离子方程式是 。
(1)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及 。
(1)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为 。
(1)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因 。
(1)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol?L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示) 。

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是 。
步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、 。
(1)步骤④的离子方程式是 。
(1)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及 。
(1)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为 。
(1)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因 。
(1)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol?L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示) 。
(1)玻璃棒、烧杯、漏斗 (1分) ;冷却结晶、过滤、洗涤、干燥(1分)
(1)Fe2++2HCO3-=FeCO3↓+H2O+CO2↑(2分)
(1)防止Fe2+被氧化(1分)
(1)1: 4 (2分)
(1)FeCO3(s)
 Fe2+(aq)+ CO32-(aq) CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液(2分)
Fe2+(aq)+ CO32-(aq) CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液(2分) (1)13.9/a ×100%(2分)
试题分析:
(1)过滤用的仪器:玻璃棒、烧杯、漏斗 ;“冷却结晶、过滤、洗涤、干燥”从溶液变成纯固体。
“冷却结晶、过滤、洗涤、干燥”从溶液变成纯固体。
(2)Fe2++2HCO3-→FeCO3↓+H2O+CO2↑
(3)隔绝空气,防止Fe2+被氧化 。
(4)4FeSO4+ O2 =4SO3 + 2 Fe2O3 氧化剂O2和还原剂FeSO4的物质的量之比 1: 4 。
(6)FeSO4和KMnO4反应的关系式 解:设20.00 mL溶液含FeSO4的物质的量为x
10FeSO4·7H2O ——2 KMnO4
2
x 0.1000*20.00/1000 x=0.01
100 mL FeSO4·7H2O的物质的量为0.01*5=0.05 (mol)
FeSO4·7H2O的质量分数为278*0.05*100%/a=13.9/a ×100%

练习册系列答案
相关题目