题目内容
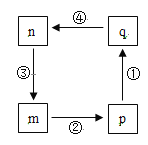
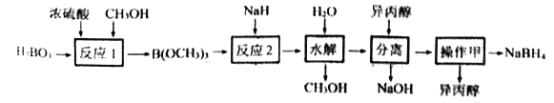
【题目】NaBH4容易与H+反应产生氢气而成为储氢材料研究的热点。以硼酸为原料制备NaBH4的一种工艺流程如下图所示:
已知: ①H3BO3电离:H3BO3+H2O![]() [B(OH)4]-+H+
[B(OH)4]-+H+
②反应1: H3BO3+3CH3OH![]() B(OCH3)3+3H2O
B(OCH3)3+3H2O
③反应2:B(OCH3)3+4NaH= NaBH4+ 3CH3ONa
(1)H3BO3是____元酸,NaH的电子式为_______________。
(2)NaBH4与水剧烈反应放出H2。反应的化学方程式为________________。
(3)反应1属于______(填有机反应类型),反应过程中蒸出B(OCH3)3的目的是__________。
(4)“水解”时产生的大量NaOH,减缓了NaBH4与水的反应。在该步骤中,与水反应生成大量NaOH的物质是_________。
(5)“分离”后得到NaBH4的异丙醇溶液。操作甲是_____________。
(6)上述流程中可以循环使用的物质是____________。
(7)以惰性电极电解Na[B(OH)4]与NaOH 混合溶液也能制得NaBH4。阴极的电极反应式为___。
【答案】 一 ![]() NaBH4+4H2O=Na[B(OH)4]+4H2↑ 取代(或酯化)反应 降低生成物的浓度,有利于反应1向正反应方向移动 CH3ONa、NaH 蒸馏 CH3OH、异丙醇 [B(OH)4] -+8e-+4H2O=BH4-+8OH-
NaBH4+4H2O=Na[B(OH)4]+4H2↑ 取代(或酯化)反应 降低生成物的浓度,有利于反应1向正反应方向移动 CH3ONa、NaH 蒸馏 CH3OH、异丙醇 [B(OH)4] -+8e-+4H2O=BH4-+8OH-
【解析】考查化学工艺流程,(1)判断某酸属于几元酸,看电离出H+的个数,根据信息①,H3BO3只能电离出一个H+,因此H3BO3属于一元酸;NaH中Na显+1价,H显-1价,NaH属于离子化合物,因此NaH的电子式为![]() ;(2)NaBH4中Na显+1价,B显+3价,H显-1价,H2O的H显+1价,因此发生化学方程式为NaBH4+4H2O=NaB(OH)4+4H2↑;(3)根据信息②,CH3OH属于醇,H3BO3属于含氧酸,因此CH3OH与H3BO3发生取代反应或酯化反应;信息②,反应1属于可逆反应,蒸出B(OCH3)3,降低生成物的浓度,促使反应向正反应方向进行,提高原料的利用;(4)反应2中加入NaH,水解时加入H2O,因此NaH与H2O反应:NaH+H2O=NaOH+H2↑,CH3ONa+H2O=CH3OH+NaOH,因此该步骤中,与水反应生成大量的NaOH的物质是NaH和CH3ONa;(5)NaHB4的异丙醇溶液,它们互为混合,利用其沸点不同,采用蒸馏的方法进行分离;(6)根据流程,循环使用的物质是CH3OH和异丙醇;(7)制备NaBH4,H的化合价降低,在阴极上得到电子,因此阴极反应式为[B(OH)4] -+8e-+4H2O=BH4-+8OH-。
;(2)NaBH4中Na显+1价,B显+3价,H显-1价,H2O的H显+1价,因此发生化学方程式为NaBH4+4H2O=NaB(OH)4+4H2↑;(3)根据信息②,CH3OH属于醇,H3BO3属于含氧酸,因此CH3OH与H3BO3发生取代反应或酯化反应;信息②,反应1属于可逆反应,蒸出B(OCH3)3,降低生成物的浓度,促使反应向正反应方向进行,提高原料的利用;(4)反应2中加入NaH,水解时加入H2O,因此NaH与H2O反应:NaH+H2O=NaOH+H2↑,CH3ONa+H2O=CH3OH+NaOH,因此该步骤中,与水反应生成大量的NaOH的物质是NaH和CH3ONa;(5)NaHB4的异丙醇溶液,它们互为混合,利用其沸点不同,采用蒸馏的方法进行分离;(6)根据流程,循环使用的物质是CH3OH和异丙醇;(7)制备NaBH4,H的化合价降低,在阴极上得到电子,因此阴极反应式为[B(OH)4] -+8e-+4H2O=BH4-+8OH-。