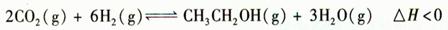��Ŀ����
����ú��ƶ�͡����������ҹ���Դ��չ���ٵ���״��������Դ��������ţ���չ��ú���������ҹ���Դ�ṹ�ĵ���������Ҫ���塣��ͼ��ú������ҵ��֮һ��
���ྻú�������о����������൱�ձ飬������Աͨ�������ú������¯�н�����������ˮ�����ķ���������������ֵ�ܸߵ�ú̿�ϳ���������Ҫ�ɷ���CO��H2��CO��H2����Ϊ��Դ�ͻ���ԭ�ϣ�Ӧ��ʮ�ֹ㷺��
��1����֪��C(s)+O2(g)=CO2(g) ��H1����393.5 kJ��mol�C1 ��
C(s)+H2O(g)=CO(g)+H2(g) ��H2����131.3 kJ��mol�C1 ��
��ӦCO(g)+H2(g) +O2(g)= H2O(g)+CO2(g)����H= _________kJ��mol�C1���ڱ�״���£�33.6 L��ú̿�ϳ���(��ȫ��ΪCO��H2)��������ȫ��Ӧ����CO2��H2O����Ӧ��ת��______mole����
��2����һ���ݵ��ܱ������У���CO��H2�ϳɼ״���CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
������������˵��������Ӧ�Ѵﵽƽ��״̬����_______
a����ϵѹǿ���ֲ���
b���ܱ�������CO��H2��CH3OH(g)3�����干��
c��CH3OH��H2���ʵ���֮��Ϊ1:2
d��ÿ����1 mol CO��ͬʱ����2molH2
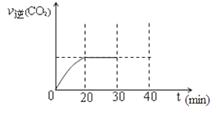
��CO��ƽ��ת����(��)���¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��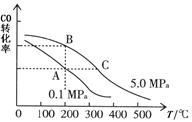
A��B�����ƽ�ⳣ��_____(�ǰ�ߡ��������ߡ���һ����)�ﵽA��C�����ƽ��״̬�����ʱ��tA tC(����ڡ�����С�ڡ����ڡ�)��
�ڲ��ı䷴Ӧ������������£�Ϊ���CO��ת���ʿɲ�ȡ�Ĵ�ʩ��_____________(������㼴��)��
��3�������¶�650���������ȼ�ϵ�أ�����ú̿��(CO��H2)������ȼ����������CO2�Ļ������Ϊ����ȼ������һ��������Li2CO3��Na2CO3���۵�����������ʣ��Խ�����(ȼ�ϼ�)Ϊ�����Ƴɵġ������ĵ缫��ӦʽΪ��CO + H2��4e�� + 2CO32��= 3CO2+H2O����õ�ص�������ӦʽΪ____________��
��1�� ��524.8 (2��) 3 (2��)
��2�� ��a d (2��)
��һ�� (2��) ���� (2��) ���¡���ѹ�����״��ӻ����ϵ�з������ (2��)
��3�� O2 + 4e�C + 2CO2 = 2CO32�C (2��)
���������������1�����ݸ�˹���ɣ��������Ȼ�ѧ����ʽ��������٣��ڵã�CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g)����H=��H1����H2����393.5 kJ��mol�C1��131.3 kJ��mol�C1����524.8kJ��mol�C1��CO��CO2ת��2mole�C��H2��H2Oת��2mole�C����1.5molCO��H2�Ļ��������O2��ȫ��Ӧ����CO2��H2Oʱ��ת��3mol���ӡ���2����a������ӦΪ�����������С�ķ�Ӧ����ѹǿ����ʱ��˵��������Ũ�Ȳ��ٱ仯����Ӧ�ﵽƽ��״̬��b��CO��H2��CH3OH(g)3�����干��ʱ������ȷ��Ũ���Ƿ�ᷢ���仯��������ȷ���Ƿ���һ���ﵽƽ��״̬��c��CH3OH��H2���ʵ���֮��Ϊ1:2������ȷ����Ũ�Ȳ��䣬��ˣ�����ȷ���Ƿ���һ���ﵽƽ��״̬����d��������1 mol CO��ͬʱ����2molH2ʱ��˵�����淴Ӧ������ȣ�����Ӧ�ﵽƽ��״̬����A��B������¶���ͬ������ƽ�ⳣ����ȣ���ͼ����A��C�����ת������ȣ���C����¶ȸߣ���Ӧ���ʴ���ƽ���ʱ��̡���ͼ�����¶Ƚ���CO��ת�������÷�ӦΪ�����������С�ķ�Ӧ����ѹ��ʹƽ��������Ӧ�����ƶ���CO��ת��������c(CH3OH)��С��ƽ��Ҳ��������Ӧ�����ƶ���CO��ת��������3��ȼ�յ�ص�����ΪO2�õ��ӣ����ǵ�����ܷ�ӦΪH2��CO��O2��Ӧ����CO2��H2O����������CO32�C���뷴Ӧ��������Ӧ����CO32�C���ɣ���������ӦʽΪ��O2 + 4e�C + 2CO2 = 2CO32�C��
���㣺���鷴Ӧ�ȵļ��㡢��ѧƽ��״̬���жϡ�ƽ���ƶ�ԭ����Ӧ�ü�ԭ��ص缫��Ӧʽ����д������ѧ���ۺϷ�����������ѧ֪ʶ���������������

CO2��CO�ǹ�ҵ�ŷŵĶԻ�������Ӱ��ķ�����
��1����CO2��NH3Ϊԭ�Ϻϳɻ������ص���Ҫ��Ӧ���£�
��2NH3(g)��CO2(g)��NH2CO2NH4(s)����H����159.47 kJ��mol��1
��NH2CO2NH4(s)��CO(NH2)2(s)��H2O(g)����H��a kJ��mol��1
��2NH3(g)��CO2(g)��CO(NH2)2(s)��H2O(g)����H����86.98 kJ��mol��1
��aΪ ��
��2����ѧ��������ù�ҵ�����е�CO2��ȡ�״���CO2+3H2CH3OH+H2O���Ƶõ�CH3OH������ȼ�ϵ�ص�ȼ�ϡ�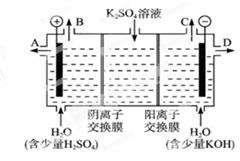
����KOH�����У������ĵ缫��ӦʽΪ_________________________________��
�������ʵ�KOH�����õ��K2SO4��Һ�ķ����Ƶá���KOH��_______���ڵõ�,�����ĵ缫��Ӧʽ�ǣ�_____________________________________��
��3������CO��H2��Ӧ�ɺϳ�CH3OCH3��
��֪��3H2(g) + 3CO(g)  CH3OCH3(g) + CO2(g)����H��-247kJ/mol
CH3OCH3(g) + CO2(g)����H��-247kJ/mol
��һ�������µ��ܱ������У��÷�Ӧ�ﵽƽ�⣬Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ�� .
| A�����¸�ѹ�� | B����������� | C�����������뺤���� | D������CO��Ũ�ȣ�E������������� |
 CH3OCH3(g) + H2O(g)����ij�¶��£���1L�ܱ������м���CH3OH ����Ӧ��10����ʱ�ﵽƽ�⣬��ʱ��ø���ֵ�Ũ�����£�
CH3OCH3(g) + H2O(g)����ij�¶��£���1L�ܱ������м���CH3OH ����Ӧ��10����ʱ�ﵽƽ�⣬��ʱ��ø���ֵ�Ũ�����£�| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/��mol��L��1�� | 0.01 | 0.2 | 0.2 |
��0-10 min�ڷ�Ӧ����v(CH3OH) �� ��
�ڸ��¶��µ�ƽ�ⳣ��Ϊ ��
����ƽ��������������ټ���0.01mol CH3OH��0.2mol CH3OCH3����ʱ�����淴Ӧ���ʵĴ�С��
v�� v�� ���>������<������)��
��15�֣����Ŵ�����Ⱦ���������أ��������ڡ�ʮ���塱�ڼ䣬����������(SO2)�ŷ�������8%����������(NOx)�ŷ�������10%��Ŀǰ������������Ⱦ�ж��ַ�����
(1)��CH4����ԭ��������������������������Ⱦ����֪��
��CH4(g)+4NO2(g)��4NO(g) + CO2(g) +2H2O(g) �SH�� -574 kJ��mol��1
��CH4(g) +4NO(g)��2N2(g) + CO2(g) + 2H2O(g) �SH��-1160 kJ��mol��1
��H2O(g)��H2O(l) ��H��-44.0 kJ��mol��1
д��CH4(g)��NO2(g)��Ӧ����N2 (g)��CO2 (g)��H2O(1)���Ȼ�ѧ����ʽ ��
��2������Fe2+��Fe3+�Ĵ����ã������¿ɽ�SO2ת��ΪSO42-���Ӷ�ʵ�ֶ�SO2����������֪��SO2�ķ���ͨ�뺬Fe2+��Fe3+����Һʱ������һ����Ӧ�����ӷ���ʽΪ4Fe2+ + O2+ 4H+ ��4Fe3+ + 2H2O������һ��Ӧ�����ӷ���ʽΪ ��
(3)�û���̿��ԭ��������������йط�ӦΪ��C(s)+2NO(g) N2(g)+CO2(g)��ij�о�С�����ܱյ���������У���������������䣬��������������Բ��ƣ�����NO�������Ļ���̿������(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2(g)+CO2(g)��ij�о�С�����ܱյ���������У���������������䣬��������������Բ��ƣ�����NO�������Ļ���̿������(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
Ũ��/mol��L��1
| NO | N2 | CO2 | ||
| 0 | 1.00 | 0 | 0 | ||
| 10 | 0.58 | 0.21 | 0.21 | ||
| 20 | 0.40 | 0.30 | 0.30 | ||
| 30 | 0.40 | 0.30 | 0.30 | ||
| 40 | 0.32 | 0.34 | 0.17 | ||
| 50 | 0.32 | 0.34 | 0.17 |
��10min��20min��v(CO2) ��ʾ�ķ�Ӧ����Ϊ ��
�ڸ��ݱ������ݣ�����T1��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ ���� ��������λС������
��һ���¶��£�����NO����ʼŨ��������NO��ƽ��ת���� ������������䡱��С���� ��
�����и�������Ϊ�жϸ÷�Ӧ�ﵽƽ����� ������ ���������ĸ����
A��������ѹǿ���ֲ��䡡�� B��2v��(NO)��v��(N2)
C��������CO2������������� D�����������ܶȱ��ֲ���
��30minĩ�ı�ijһ��������һ��ʱ�䷴Ӧ���´ﵽƽ�⣬��ı������������ ��������ͼ�л���30min��40min�ı仯���ߡ�
��I����ͼ�ǹ�ҵ��������淋����̡�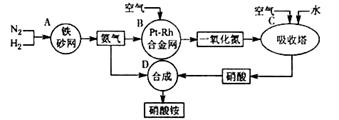
��1��������C��ͨ�������Ŀ���� ��A��B��C��D�ĸ������еķ�Ӧ������������ԭ��Ӧ���� ������ĸ����
��2����֪��4NH3(g) + 3O2(g) = 2N2(g) +6H2O(g) ��H =��1266.8kJ/mol
N2(g) + O2(g) = 2NO(g) ��H =" +180.5" kJ/mol
д�������´��������Ȼ�ѧ����ʽ��
��II��ij����С��ͬѧ��ͭƬ����ϡ���ᣬ���ֿ�ʼʱ��Ӧ�dz�����һ��ʱ���Ӧ�������Լӿ졣��С��ͨ��ʵ��̽����ԭ��
��3���÷�Ӧ�����ӷ���ʽΪ___________________________________________________��
��4������������衣��ʵ���з�Ӧ�������Լӿ��ԭ�������_____________________��
A����Ӧ���ȵ����¶����� B��ѹǿ����
C���������д����� D����Ӧ��Ӵ��������
��5������̽�����ⶨ��Ӧ��������Һ��ͬʱ����¶ȣ�������±���
| ʱ��/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| �¶�/�� | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
���ʵ��Ŀ�ĺͱ������ݣ���ó��Ľ�����__________________________________��
��6����һ��̽�������������˽��ѧ��Ӧ�IJ�����м������ܶԷ�Ӧ�д����ã����������ʵ����Ʊ�����ʵ��Ŀ�IJ���������
| ʵ�� ��� | ͭƬ ����/g | 0.1mol��L-1�� �������/mL | ����ͭ ����/g | �������� ����/g | ʵ��Ŀ�� |
| �� | 5 | 20 | _______ | _______ | ʵ��ٺ͢�̽��_________��Ӱ�죻ʵ��ٺ͢�̽�����������Ӱ�졣 |
| �� | 5 | 20 | 0.5 | 0 | |
| �� | 5 | 20 | 0 | 0.5 |
�״���һ�����͵���Դ��
��1���ϳ��������ΪH2��CO���������״�����Ҫԭ�ϣ���д���ɽ�̿��ˮ�ڸ�������ȡ�ϳ����Ļ�ѧ����ʽ ��
��2����֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ��mol-1��-283.0kJ��mol-1��-726.5kJ��mol-1����״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ ��
��3�����ݻ�Ϊl L���ܱ������У���CO��H2�ϳɼ״����������������������£������¶ȶԷ�Ӧ��Ӱ�죬ʵ��������ͼ��ʾ��ע��T1��T2������300�棩��
����˵����ȷ���� ������ţ�
A���¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״���ƽ������Ϊv(CH3OH)=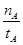 (mol��L-1��min-1) (mol��L-1��min-1) |
| B���÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ�Ĵ� |
| C���÷�ӦΪ���ȷ�Ӧ |
D������A��ķ�Ӧ��ϵ��T1�䵽T2���ﵽƽ��ʱ ��С ��С |
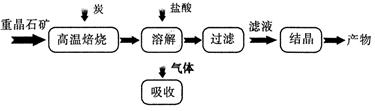
��5����ֱ���Լ״�Ϊȼ�ϵĵ���У��������ҺΪ���ԣ������ķ�ӦʽΪ ������ԭ�����ΪNaOH���ҵ�ع���һ��ʱ�������ֻ��Na2CO3����ʱ��Һ�и�����Ũ�ȴ�С��ϵΪ
����֪Ksp(AgCl)=1.56��10-10��Ksp(AgBr)=7.7��10-13��Ksp(Ag2CrO4)=9��10-11��ij��Һ�к���C1-�� Br-��CrO42-��Ũ�Ⱦ�Ϊ0.010mo1��L-1�������Һ����μ���0.010mol��L-1��AgNO3��Һʱ�����������Ӳ����������Ⱥ�˳��Ϊ ��
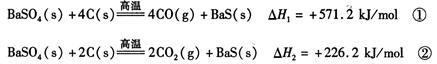
 2CO(g)�ġ�H = kJ/mol
2CO(g)�ġ�H = kJ/mol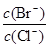 = ��[��֪��
= ��[��֪�� O2(g)��CO(g)��2H2(g) ��H2=��35.4 kJ��mol-1
O2(g)��CO(g)��2H2(g) ��H2=��35.4 kJ��mol-1 [Cu(NH3)3]Ac��CO ��H��0
[Cu(NH3)3]Ac��CO ��H��0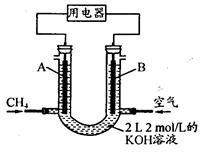
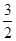 O2(g)=CO2(g)��2H2O(l)����H����764.5 kJ��mol��1
O2(g)=CO2(g)��2H2O(l)����H����764.5 kJ��mol��1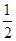 O2(g)=CO2(g)����H����283.0 kJ��mol��1
O2(g)=CO2(g)����H����283.0 kJ��mol��1 CH3OH(g)����H��________kJ��mol��1
CH3OH(g)����H��________kJ��mol��1