题目内容
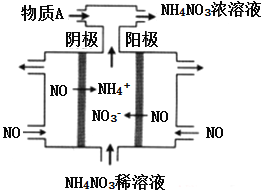
【题目】某氮肥厂氨氮废水中的氮元素多以NH![]() 和NH3·H2O的形式存在,该废水的处理流程如下:
和NH3·H2O的形式存在,该废水的处理流程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收。
用离子方程式表示加NaOH溶液的作用:______________________________________。
(2)过程Ⅱ:在微生物作用的条件下,NH![]() 经过两步反应被氧化成NO
经过两步反应被氧化成NO![]() 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:

第一步反应是________反应(选填“放热”或“吸热”),判断依据是________。
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是________。
【答案】(1) NH4++OH-![]() NH3↑+H2O (2分)
NH3↑+H2O (2分)
(2)放热(1分);反应物总能量高于生成物总能量(2分); (3)5∶6(3分)
【解析】
试题(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30 ℃,通空气将氨赶出并回收。用离子方程式表示加NaOH溶液的作用是H4++OH-![]() NH3↑+H2O;(2)根据图示可知:反应物的能量高三生成物的能量,所以当反应发生时多余的能量就释放出来,因此第一步反应是放热反应;(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,甲醇在反应中失去电子,作还原剂,而硝酸在反应中得到电子,作氧化剂,甲醇将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,每1mol的稀释在反应中得到5mol的电子。根据氧化还原反应中电子转移的数目相等可得:参加反应的还原剂和氧化剂的物质的量之比是5∶6。
NH3↑+H2O;(2)根据图示可知:反应物的能量高三生成物的能量,所以当反应发生时多余的能量就释放出来,因此第一步反应是放热反应;(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,甲醇在反应中失去电子,作还原剂,而硝酸在反应中得到电子,作氧化剂,甲醇将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,每1mol的稀释在反应中得到5mol的电子。根据氧化还原反应中电子转移的数目相等可得:参加反应的还原剂和氧化剂的物质的量之比是5∶6。

练习册系列答案
相关题目