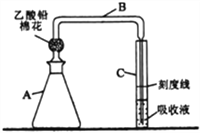
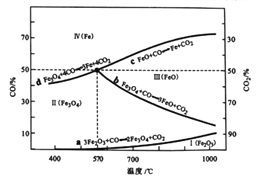
题目内容
【题目】钛及其化合物的应用正越来越受到人们的关注。
(1)基态下原子核外电子排布的最高能级的符号是_____________。与钛同周期的元素中,基态原子的未成对电子数与钛相同的有_____种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是________________________。
(3)TiCl4是氯化法制取钛的中间产物。TiCl4和SiCl4在常温下都是液体,分子结构相同。采用蒸馏的方法分离SiCl4和TiCl4的混合物,先获得的馏分是______________(填化学式)。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如右图所示。
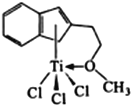
①组成该物质的元素中,电负性最大的是____________ (填元素名称)。
②M中,碳原子的杂化形式有________种。
③M中,不含_________(填标号)。
a. π键 b. σ键 c.配位键 d.氢键 e.离子键
(5)金红石(TiO2)是含钛的主要矿物之一,具有四方晶系结构。其晶胞结构(晶胞中相同位置的原子相同)如下图所示。
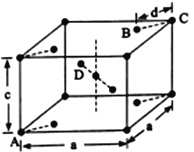
①4个微粒A、B、C、D中,属于氧原子的是______________。
②若A、B、C的原子坐标分别为A (0,0,0)、B (0.69a,0.69a,c)、c (a, a,c),则D的原子坐标为D (0.19a,_____,______);钛氧键的键长d=________________(用代数式表示)。
【答案】 3d 3 Ti原子的价电子数比Al多,金属键更强)((或Ti的原子化热比Al大,金属键更强等其他合理答案) SiCl4 氧 2 d、e BD 0.81a 0.5c 0.31×![]() a
a
【解析】(1)基态 Ti 原子核外电排布为 1S 22S 22P 63S 23P 63d 24S 2,且未成对电子数为2,基态下原子核外电子排布的最高能级的符号是3d。第 4周期元素中,基态原子的未成对电数与钛相同的有 Ni (3d 84S 2)、 Ge (4S 24P 2)、 Se (4S 24P 4)3种;(2)钛与铝同为金属晶体,金属晶体的硬度主要由金属键决定,钛硬度比铝大的原因是Ti原子的价电子数比Al多,金属键更强)(或Ti的原子化热比Al大,金属键更强等其他合理答案)。(3)由TiCl4和 SiCl 4在常温下都是液体,可知,两者均属于分子晶体且分子结构相同,分子间作用力是影响晶体物理性质的主要因素,相对分子质量越大分子间作用力越大,所以,TiCl4比SiCl 4沸点高。采用蒸馏的方法分离SiCl4和TiCl4的混合物,先获得的馏分是SiCl 4;。
(4)半夹心结构催化剂M中含有C、H、0、Ti、Cl 五种元素,电负性大小顺序为O>Cl>C>H>Ti,①组成该物质的元素中,电负性最大的是 氧。;碳原子的杂化形式有sp2、sp3两种,②M中,碳原子的杂化形式有2种;在半夹心分子结构中,C-C、C-H、C-O原子间存在δ键,环中存在大π键、Ti 与O间存在配位键,不存在氢键与离子键。③M中,不含de。(5)晶体结构有7大晶系,每个晶胞含有6个晶胞参数(棱长a、b、c; 夹角αβγ),金红石(TiO2) 是典型的四方晶系,结构中A类原子8×1/8=1、B类原子4×1/2=2、D类原子2×1=2、体心原子1×1=1,原子B、D为O,①4个微粒A、B、C、D中,属于氧原子的是BD;原子A与体心原子为Ti (Ti :O= 1:2)。结合晶系与晶胞参数可得原子坐标可A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c)、D(0.19a,0.81a, 0.5c)、体心(0.5a,0.5a,0.5c)。钛氧键键长:d2=(0.31a)2+ (0.31a)2,则d= 0.31×![]() a。
a。