题目内容
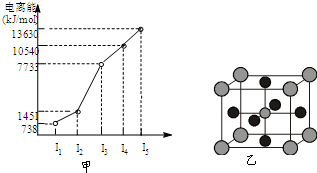 有X、Y、Z、W四种元素,原子序数依次减小.已知X是第四周期的主族元素,其部分电离能如图甲所示;X、Y元素具有相同的最高正化合价;Z 原子p轨道共有3个电子;W原子价电子排布式为nsnnpn.
有X、Y、Z、W四种元素,原子序数依次减小.已知X是第四周期的主族元素,其部分电离能如图甲所示;X、Y元素具有相同的最高正化合价;Z 原子p轨道共有3个电子;W原子价电子排布式为nsnnpn.请回答下列问题:
(1)X原子的电子排布式为
(2)第一电离能:X
(3)元素W的一种氢化物(化学式为W2H4)是重要的化工原料.有关W2H4分子的说法正确的是
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.W的原子与氢原子形成的化学键可以自由旋转
(4)X的氧化物与钛(Ti)的氧化物相互作用,能形成钛酸盐,其晶胞(晶体中最基本的重复单元)示意图如图乙所示.(X、Ti和O三种元素对应的离子分别位于立方体的体心、顶点和面心).该晶体中,钛离子和周围
(5)Z的气态氢化物分子中Z原子采用
A.离子键 B.非极性键C.配位键 D.极性键 E.金属键.
分析:X、Y、Z、W四种元素,原子序数依次减小.X是第四周期的主族元素,由图中其部分电离能可知,其第三电离能剧增,则X表现+2价,则处于ⅡA组,故X为Ca;W原子价电子排布式为nsnnpn,s能级只能容纳2个电子,则n=2,其价电子排布式为2s22p2,则W为碳元素;X、Y元素具有相同的最高正化合价,处于同主族,Y的原子序数大于碳元素,则Y为Mg;Z 原子p轨道共有3个电子,原子价电子排布式为ns2np3,处于ⅤA族,原子序数大于Mg,则Z为磷元素,据此解答.
解答:解:X、Y、Z、W四种元素,原子序数依次减小.X是第四周期的主族元素,由图中其部分电离能可知,其第三电离能剧增,则X表现+2价,则处于ⅡA组,故X为Ca;W原子价电子排布式为nsnnpn,s能级只能容纳2个电子,则n=2,其价电子排布式为2s22p2,则W为碳元素;X、Y元素具有相同的最高正化合价,处于同主族,Y的原子序数大于碳元素,则Y为Mg;Z 原子p轨道共有3个电子,原子价电子排布式为ns2np3,处于ⅤA族,原子序数大于Mg,则Z为磷元素,
(1)X为Ca,原子核外电子数为20,其原子的电子排布式为1s22s22p63s23p64s2,
故答案为:1s22s22p63s23p64s2;
(2)同主族自上而下第一电离能减小,故第一电离能:Ca<Mg,
故答案为:<;
(3)C元素的一种氢化物C2H4,分子中不含氢键,分子中C原子之间形成C=C双键、H原子与C原子之间形成C-H,为平面对称结构,属于非极性分子,含有5个σ键和1个π键,C-H单键可以自由旋转,故AC错误、BD正确,
故答案为:BD;
(4)Ca的氧化物与钛(Ti)的氧化物相互作用,能形成钛酸盐,Ca、Ti和O三种元素对应的离子分别位于晶胞立方体的体心、顶点和面心,以定点的Ti离子研究,与之最近的氧离子位于面心上,每个Ti离子为12个面共用,则钛离子和周围12个氧离子相紧邻;
晶胞中两个Ti原子的最近距离为晶胞棱长,晶胞中Ca离子数目=1,Ti离子数目=8×
=1,O离子数目=6×
=3,则晶胞质量=
g=
g,晶胞体积=
=
cm3,故两个Ti原子的最近距离=
cm,
故答案为:12;
;
(5)O的气态氢化物分子为PH3,P原子成3个P-H键、含有1对孤对电子,其杂化轨道数目为4,P原子采取sp3杂化,NH4Cl晶体中含有离子键、极性键、配位键,不含非极性键、金属键,
故答案为:sp3;BE.
(1)X为Ca,原子核外电子数为20,其原子的电子排布式为1s22s22p63s23p64s2,
故答案为:1s22s22p63s23p64s2;
(2)同主族自上而下第一电离能减小,故第一电离能:Ca<Mg,
故答案为:<;
(3)C元素的一种氢化物C2H4,分子中不含氢键,分子中C原子之间形成C=C双键、H原子与C原子之间形成C-H,为平面对称结构,属于非极性分子,含有5个σ键和1个π键,C-H单键可以自由旋转,故AC错误、BD正确,
故答案为:BD;
(4)Ca的氧化物与钛(Ti)的氧化物相互作用,能形成钛酸盐,Ca、Ti和O三种元素对应的离子分别位于晶胞立方体的体心、顶点和面心,以定点的Ti离子研究,与之最近的氧离子位于面心上,每个Ti离子为12个面共用,则钛离子和周围12个氧离子相紧邻;
晶胞中两个Ti原子的最近距离为晶胞棱长,晶胞中Ca离子数目=1,Ti离子数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 40+48+16×3 |
| NA |
| 136 |
| NA |
| ||
| ρ g/cm3 |
| 136 |
| ρNA |
| 3 |
| ||
故答案为:12;
| 3 |
| ||
(5)O的气态氢化物分子为PH3,P原子成3个P-H键、含有1对孤对电子,其杂化轨道数目为4,P原子采取sp3杂化,NH4Cl晶体中含有离子键、极性键、配位键,不含非极性键、金属键,
故答案为:sp3;BE.
点评:本题考查物质结构与性质,涉及核外电子排布、电离能、化学键、晶胞计算等,难度中等,注意理解电离能与化合价关系,(4)注意利用均摊法进行晶胞计算,对学生的空间想象与数学计算有一定的要求.

练习册系列答案
相关题目

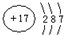

 有X、Y、Z、W四种短周期元素,原子序数依次增大.X的阳离子就是一个质子.Z、W在周期表内处于同一周期相邻位置.它们的单质在通常状况下均为无色气体.Y原子的最外层电子数是次外层电子数的2倍.请回答:
有X、Y、Z、W四种短周期元素,原子序数依次增大.X的阳离子就是一个质子.Z、W在周期表内处于同一周期相邻位置.它们的单质在通常状况下均为无色气体.Y原子的最外层电子数是次外层电子数的2倍.请回答: