题目内容
有X、Y、Z、W四种物质的水溶液,它们分别是Na2CO3、NaOH、CH3COOH和NaCl中的一种.已知X、Y两溶液中水的电离程度相同,X、Z两溶液的pH相同,请回答下列问题:(1)X是
(2)Z、W两溶液中水的电离程度由大到小的顺序为
(3)写出Z溶液与过量Y溶液反应的离子方程式
(4)X、Y两溶液恰好完全反应后,溶液中各离子浓度由大到小的顺序是
分析:碳酸钠中碳酸根离子水解溶液显示碱性,促进了水的电离,氯化钠在溶液中不水解,溶液显示中性,氢氧化钠和醋酸都抑制了水的电离,根据X、Y两溶液中水的电离程度相同可知,X、Y为NaOH、CH3COOH;X、Z两溶液的pH相同,所以X、Z为Na2CO3、NaOH,故X为NaOH、Y为CH3COOH、Z为Na2CO3、W为NaCl,
(1)根据以上分析写出X、Z的化学式;
(2)碳酸钠溶液中碳酸根离子水解,氯化钠溶液中钠离子和氯离子不水解;
(3)碳酸钠与醋酸反应生成醋酸钠、二氧化碳和水,据此写出反应的离子方程式;
(4)醋酸与氢氧化钠恰好反应生成了醋酸钠,醋酸钠溶液显示碱性,硝酸根离子部分水解,据此判断溶液中离子浓度大小关系.
(1)根据以上分析写出X、Z的化学式;
(2)碳酸钠溶液中碳酸根离子水解,氯化钠溶液中钠离子和氯离子不水解;
(3)碳酸钠与醋酸反应生成醋酸钠、二氧化碳和水,据此写出反应的离子方程式;
(4)醋酸与氢氧化钠恰好反应生成了醋酸钠,醋酸钠溶液显示碱性,硝酸根离子部分水解,据此判断溶液中离子浓度大小关系.
解答:解:Na2CO3中碳酸根离子水解溶液显示碱性,促进了水的电离,NaCl在溶液中不水解,溶液显示中性,NaOH和CH3COOH都抑制了水的电离,根据X、Y两溶液中水的电离程度相同可知,X、Y为NaOH、CH3COOH;X、Z两溶液的pH相同,所以X、Z为Na2CO3、NaOH,故X为NaOH、Y为CH3COOH、Z为Na2CO3、W为NaCl,
(1)根据以上分析可知,X为NaOH、Z为Na2CO3,故答案为:NaOH;Na2CO3;
(2)Z为Na2CO3、W为NaCl,碳酸钠溶液中碳酸根离子促进了水的电离,而氯化钠溶液中离子不水解,对水的电离没有影响,所以Na2CO3、NaCl溶液中水的电离程度由大到小的顺序为:Na2CO3>NaCl,
故答案为:Na2CO3>NaCl;
(3)Y为CH3COOH、Z为Na2CO3,碳酸钠与过量的醋酸反应的离子方程式为:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O,
故答案为:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O;
(4)X为NaOH、Y为CH3COOH,二者恰好反应生成了醋酸钠,醋酸钠溶液中醋酸根离子部分水解,溶液显示碱性,所以醋酸钠溶液中离子浓度大小关系为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
(1)根据以上分析可知,X为NaOH、Z为Na2CO3,故答案为:NaOH;Na2CO3;
(2)Z为Na2CO3、W为NaCl,碳酸钠溶液中碳酸根离子促进了水的电离,而氯化钠溶液中离子不水解,对水的电离没有影响,所以Na2CO3、NaCl溶液中水的电离程度由大到小的顺序为:Na2CO3>NaCl,
故答案为:Na2CO3>NaCl;
(3)Y为CH3COOH、Z为Na2CO3,碳酸钠与过量的醋酸反应的离子方程式为:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O,
故答案为:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O;
(4)X为NaOH、Y为CH3COOH,二者恰好反应生成了醋酸钠,醋酸钠溶液中醋酸根离子部分水解,溶液显示碱性,所以醋酸钠溶液中离子浓度大小关系为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
点评:本题考查了未知物的检验、盐的水解原理、溶液中离子浓度大小比较等知识,题目难度中等,注意掌握检验检验未知物的方法,明确盐的水解原理及比较溶液中离子浓度大小关系的方法.

练习册系列答案
相关题目

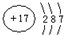

 有X、Y、Z、W四种短周期元素,原子序数依次增大.X的阳离子就是一个质子.Z、W在周期表内处于同一周期相邻位置.它们的单质在通常状况下均为无色气体.Y原子的最外层电子数是次外层电子数的2倍.请回答:
有X、Y、Z、W四种短周期元素,原子序数依次增大.X的阳离子就是一个质子.Z、W在周期表内处于同一周期相邻位置.它们的单质在通常状况下均为无色气体.Y原子的最外层电子数是次外层电子数的2倍.请回答: