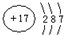题目内容
 有X、Y、Z、W四种短周期元素,原子序数依次增大.X的阳离子就是一个质子.Z、W在周期表内处于同一周期相邻位置.它们的单质在通常状况下均为无色气体.Y原子的最外层电子数是次外层电子数的2倍.请回答:
有X、Y、Z、W四种短周期元素,原子序数依次增大.X的阳离子就是一个质子.Z、W在周期表内处于同一周期相邻位置.它们的单质在通常状况下均为无色气体.Y原子的最外层电子数是次外层电子数的2倍.请回答:(1)Z2的电子式为
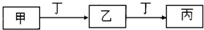
(2)将X2、W2按R如图所示通入某燃料电池中,其中b电极为
(3)X、Y两种元素组成一种气体,在标准状况下密度为1.25g?L-1,实验室制取该气体的化学方程式为
(4)由X、Y、Z、W四种元素组成的酸式盐与足量的NaOH溶液在加热条件下反应的离子方程式为
分析:X、Y、Z、W四种短周期元素,原子序数依次增大.X的阳离子就是一个质子,则X为H;Y原子的最外层电子数是次外层电子数的2倍,Y为第二周期元素,最外层电子数为2×2=4,则Y为C,所以可知Z、W在周期表内处于同一周期相邻位置,它们的单质在通常状况下均为无色气体,Z、W位于第二周期,分别为N、O.
(1)Z2为氮气,存在N≡N;
(2)氢氧燃料电池中,通氢气一端为负极,通氧气一端为正极,正极上氧气得到电子;
(3)在标准状况下密度为1.25g?L-1,M=1.25×22.4=28,则该烃为C2H4,实验室利用乙醇和浓硫酸反应制备;
(4)X、Y、Z、W四种元素组成的酸式盐为NH4HCO3,与NaOH加热反应生成氨气、水和碳酸钠.
(1)Z2为氮气,存在N≡N;
(2)氢氧燃料电池中,通氢气一端为负极,通氧气一端为正极,正极上氧气得到电子;
(3)在标准状况下密度为1.25g?L-1,M=1.25×22.4=28,则该烃为C2H4,实验室利用乙醇和浓硫酸反应制备;
(4)X、Y、Z、W四种元素组成的酸式盐为NH4HCO3,与NaOH加热反应生成氨气、水和碳酸钠.
解答:解:X、Y、Z、W四种短周期元素,原子序数依次增大.X的阳离子就是一个质子,则X为H;Y原子的最外层电子数是次外层电子数的2倍,Y为第二周期元素,最外层电子数为2×2=4,则Y为C,所以可知Z、W在周期表内处于同一周期相邻位置,它们的单质在通常状况下均为无色气体,Z、W位于第二周期,分别为N、O.
(1)Z2为氮气,存在N≡N,其电子式为 ,故答案为:
,故答案为: ;
;
(2)氢氧燃料电池中,通氢气一端为负极,通氧气一端为正极,所以b为正极,正极上氧气得到电子,电极反应为O2+2H2O+4e-=4OH-,
故答案为:正;O2+2H2O+4e-=4OH-;
(3)在标准状况下密度为1.25g?L-1,M=1.25×22.4=28,则该烃为C2H4,实验室利用乙醇和浓硫酸反应制备,反应方程式为C2H5OH
CH2=CH2↑+H2O,
故答案为:C2H5OH
CH2=CH2↑+H2O;
(4)X、Y、Z、W四种元素组成的酸式盐为NH4HCO3,与NaOH加热反应生成氨气、水和碳酸钠,离子反应为NH4++HCO3-+2OH-
NH3↑+2H2O+CO32-,
故答案为:NH4++HCO3-+2OH-
NH3↑+2H2O+CO32-.
(1)Z2为氮气,存在N≡N,其电子式为
 ,故答案为:
,故答案为: ;
;(2)氢氧燃料电池中,通氢气一端为负极,通氧气一端为正极,所以b为正极,正极上氧气得到电子,电极反应为O2+2H2O+4e-=4OH-,
故答案为:正;O2+2H2O+4e-=4OH-;
(3)在标准状况下密度为1.25g?L-1,M=1.25×22.4=28,则该烃为C2H4,实验室利用乙醇和浓硫酸反应制备,反应方程式为C2H5OH
| 浓硫酸 |
| 170℃ |
故答案为:C2H5OH
| 浓硫酸 |
| 170℃ |
(4)X、Y、Z、W四种元素组成的酸式盐为NH4HCO3,与NaOH加热反应生成氨气、水和碳酸钠,离子反应为NH4++HCO3-+2OH-
| ||
故答案为:NH4++HCO3-+2OH-
| ||
点评:本题考查位置、结构、性质的关系及应用,元素的推断为解答的关键,涉及电子式、原电池、离子反应及乙烯的制取等,综合性较强,但题目难度不大.

练习册系列答案
相关题目