题目内容
(2013?重庆二模)有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
(1)A原子核外比X原子多3个电子,A的原子结构示意图是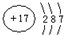
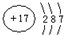
含1mol X的氧化物晶体中含有共价键数目为
(2)Z与钙离子组成的化合物的电子式为

(3)14g Y完全燃烧放出的热量是141.5kJ,写出Y燃烧的热化学方程式
(4)组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系(反应条件和其他物质已略)
①写出丁在高温下与水反应的化学方程式
②组成W的元素的简单氢化物极易溶于水的主要原因是
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
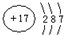
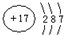
含1mol X的氧化物晶体中含有共价键数目为
4NA
4NA
(2)Z与钙离子组成的化合物的电子式为


(3)14g Y完全燃烧放出的热量是141.5kJ,写出Y燃烧的热化学方程式
2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
(4)组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系(反应条件和其他物质已略)

①写出丁在高温下与水反应的化学方程式
3Fe+4H2O(g)
Fe3O4+4H2或C+H2O(g)
CO+H2
| ||
| ||
3Fe+4H2O(g)
Fe3O4+4H2或C+H2O(g)
CO+H2
| ||
| ||
②组成W的元素的简单氢化物极易溶于水的主要原因是
NH3与H2O间能形成氢键
NH3与H2O间能形成氢键
,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O
2NH3-6e-+6OH-=N2+6H2O
.分析:X、Y、Z、W四种含14个电子的粒子,X为单核,电荷数为0,故X的质子数为14,X为Si原子;Y为不同元素构成的两核粒子,粒子电荷数为0,故Y为CO;Z为同元素构成的两核粒子,粒子电荷数为-2,故形成Z元素的原子质子数为
=6,故Z为C22-;W为同元素构成的两核粒子,粒子电荷数为0,故形成W元素的原子质子数为
=7,为N元素,W为N2,
(1)A原子核外比Si原子多3个电子,A为Cl原子,原子核外电子数为17,有3个电子层,各层电子数为2、8、7;
SiO2晶体中每个Si原子与4个O原子之间形成4个Si-O键;
(2)碳化钙为离子化合物,由钙离子与C22-离子构成,C22-离子中C原子之间形成3对共用电子对;
(3)根据n=
计算14gCO的质量,计算2molCO燃烧放出的热量,结合热化学方程式书写原则书写;
(4)①组成W的元素最高价氧化物对应的水化物甲为HNO3,由转化关系可知丁为Fe或C符合转化关系,若丁为Fe,则乙为硝酸铁,丙为硝酸亚铁;若丁为C,则乙为二氧化碳,丙为一氧化碳;
②组成W的元素的简单氢化物为NH3,NH3与H2O间能形成氢键,NH3极易溶于水;
NH3与空气可以构成一种燃料电池,负极发生氧化反应,NH3在负极放电,碱性条件下生成N2、H2O.
| 14-2 |
| 2 |
| 14 |
| 2 |
(1)A原子核外比Si原子多3个电子,A为Cl原子,原子核外电子数为17,有3个电子层,各层电子数为2、8、7;
SiO2晶体中每个Si原子与4个O原子之间形成4个Si-O键;
(2)碳化钙为离子化合物,由钙离子与C22-离子构成,C22-离子中C原子之间形成3对共用电子对;
(3)根据n=
| m |
| M |
(4)①组成W的元素最高价氧化物对应的水化物甲为HNO3,由转化关系可知丁为Fe或C符合转化关系,若丁为Fe,则乙为硝酸铁,丙为硝酸亚铁;若丁为C,则乙为二氧化碳,丙为一氧化碳;
②组成W的元素的简单氢化物为NH3,NH3与H2O间能形成氢键,NH3极易溶于水;
NH3与空气可以构成一种燃料电池,负极发生氧化反应,NH3在负极放电,碱性条件下生成N2、H2O.
解答:解:X、Y、Z、W四种含14个电子的粒子,X为单核,电荷数为0,故X的质子数为14,X为Si原子;Y为不同元素构成的两核粒子,粒子电荷数为0,故Y为CO;Z为同元素构成的两核粒子,粒子电荷数为-2,故形成Z元素的原子质子数为
=6,故Z为C22-;W为同元素构成的两核粒子,粒子电荷数为0,故形成W元素的原子质子数为
=7,为N元素,W为N2,
(1)A原子核外比Si原子多3个电子,A为Cl原子,原子核外电子数为17,有3个电子层,各层电子数为2、8、7,原子结构示意图为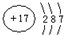 ;
;
SiO2晶体中每个Si原子与4个O原子之间形成4个Si-O键,1molSiO2晶体中含有4NA个共价键;
故答案为: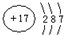 ;4NA;
;4NA;
(2)碳化钙为离子化合物,由钙离子与C22-离子构成,C22-离子中C原子之间形成3对共用电子对,碳化钙电子式为: ,
,
故答案为: ;
;
(3)14gCO的质量的物质的量为
=0.5mol,故2molCO燃烧放出的热量为
×141.5kJ=566kJ,CO燃烧的热化学方程式为:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol,
故答案为:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol;
(4)①组成W的元素最高价氧化物对应的水化物甲为HNO3,由转化关系可知丁为Fe或C符合转化关系,若丁为Fe,则乙为硝酸铁,丙为硝酸亚铁;若丁为C,则乙为二氧化碳,丙为一氧化碳;
故丁在高温下与水反应的化学方程式为:3Fe+4H2O(g)
Fe3O4+4H2或C+H2O(g)
CO+H2,
故答案为:3Fe+4H2O(g)
Fe3O4+4H2或C+H2O(g)
CO+H2;
②组成W的元素的简单氢化物为NH3,NH3与H2O间能形成氢键,NH3极易溶于水;
NH3与空气可以构成一种燃料电池,负极发生氧化反应,NH3在负极放电,碱性条件下生成N2、H2O,电解反应式为:2NH3-6e-+6OH-=N2+6H2O,
故答案为:NH3与H2O间能形成氢键;2NH3-6e-+6OH-=N2+6H2O.
| 14-2 |
| 2 |
| 14 |
| 2 |
(1)A原子核外比Si原子多3个电子,A为Cl原子,原子核外电子数为17,有3个电子层,各层电子数为2、8、7,原子结构示意图为
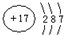 ;
;SiO2晶体中每个Si原子与4个O原子之间形成4个Si-O键,1molSiO2晶体中含有4NA个共价键;
故答案为:
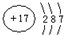 ;4NA;
;4NA;(2)碳化钙为离子化合物,由钙离子与C22-离子构成,C22-离子中C原子之间形成3对共用电子对,碳化钙电子式为:
 ,
,故答案为:
 ;
;(3)14gCO的质量的物质的量为
| 14g |
| 28g/mol |
| 2mol |
| 0.5mol |
故答案为:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol;
(4)①组成W的元素最高价氧化物对应的水化物甲为HNO3,由转化关系可知丁为Fe或C符合转化关系,若丁为Fe,则乙为硝酸铁,丙为硝酸亚铁;若丁为C,则乙为二氧化碳,丙为一氧化碳;
故丁在高温下与水反应的化学方程式为:3Fe+4H2O(g)
| ||
| ||
故答案为:3Fe+4H2O(g)
| ||
| ||
②组成W的元素的简单氢化物为NH3,NH3与H2O间能形成氢键,NH3极易溶于水;
NH3与空气可以构成一种燃料电池,负极发生氧化反应,NH3在负极放电,碱性条件下生成N2、H2O,电解反应式为:2NH3-6e-+6OH-=N2+6H2O,
故答案为:NH3与H2O间能形成氢键;2NH3-6e-+6OH-=N2+6H2O.
点评:本题考查元素化合物推断、常用化学用语、热化学方程式、原电池、氢键等,难度中等,(3)中物质推断是易错点,注意掌握元素化合物的性质.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
