题目内容
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。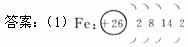
(1)i是铁元素,其原子的最外层电子数为2,请写出铁元素的原子结构示意图____________。
(2)由以上元素形成的金属单质中,熔点最低的是________________________。
(3)NH3·H2O的电离方程式为NH3·H2O![]()
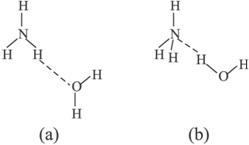
![]() +OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是____________________________________。
+OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是____________________________________。
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是__________________(填写字母)。
(5)利用稀有气体化合物,人们实现了许多制备实验上的突破。如用XeO3在碱性条件下与NaBrO3反应生成NaBrO4,同时放出Xe。写出上述反应方程式:________________________。
(6)e与g形成的化合物是_________________(填“离子”或“共价”)化合物,医疗上用于注射的该物质水溶液浓度为________________________。
解析:虽然铁不是主族元素,但在已知最外层电子数为2时,可分析推测写出铁元素的原子结构示意图:铁原子K、L层分别填充2个和8个电子,N层填充2个电子,剩下14个电子填充在M层。
因NH3·H2O电离生成![]() ,说明NH3中的N与H2O中的H之间形成了氢键,电离时水中的氢氧键断裂。
,说明NH3中的N与H2O中的H之间形成了氢键,电离时水中的氢氧键断裂。
最容易与F2化合的稀有气体原子应为最容易失去电子的原子。稀有气体中,从上至下原子半径依次增大,最外层电子受到的束缚力逐渐减弱,故Xe是最有可能的。
![]()
(2)Na(3)(b)
(4)j
(5)XeO3+3NaBrO3====3NaBrO4+Xe↑
(6)离子 0.9%

 阅读快车系列答案
阅读快车系列答案


 NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 (4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是