题目内容
【题目】已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应.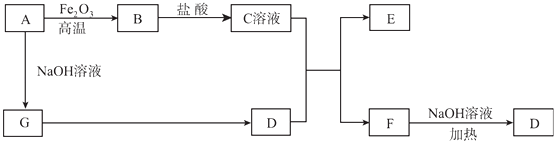
请回答下列问题:
(1)写出F的电子式:;
(2)①C溶液与D的水溶液反应的离子方程式为;②F溶液与NaOH溶液共热反应的化学方程式为;
(3)①请用离子方程式解释C溶液为何显酸性;②F溶液中离子浓度由大到小的顺序为;
(4)将5.4 g A投入到200 mL 2.0 mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是(填代号);
A.HNO3溶液
B.H2SO4溶液
C.NaOH溶液
D.HCl溶液
(5)将1mol N2和3mol G及催化剂充入容积为2 L的某密闭容器中进行反应,已知该反应为放热反应.平衡时,测得D的物质的量浓度为a mol/L.在其他条件不变的情况下,若起始时充入0.5 mol N2和1.5mol G达到平衡后,D的物质的量浓度(填“大于”“小于”或“等于”)a/2mol/L.
【答案】
(1)![]()
(2)Al3++3NH3?H2O=Al(OH)3↓+3NH4+;NH4Cl+NaOH ![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
(3)Al3++3H2O?Al(OH)3+3H+;c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣)
(4)D
(5)小于
【解析】解:A~G有如图所示的转化关系(部分生成物已略去),D是能使湿润的红色石蕊试纸变蓝色的气体,则D为NH3 , 其中A、G为单质,且A与氧化铁反应,与氢氧化钠反应反应得到G,G反应可以得到氨气,可推知A为Al、G为H2 , E、F均能与NaOH溶液反应,结合转化关系可知,故B为Al2O3 , C为AlCl3 , E为Al(OH)3 , F为NH4Cl,(1)F为NH4Cl,电子式为: ![]() ,所以答案是:
,所以答案是: ![]() ;(2)①C溶液与D反应的离子方程式为:Al3++3NH3H2O=Al(OH)3↓+3NH4+ , 所以答案是:Al3++3NH3H2O=Al(OH)3↓+3NH4+;
;(2)①C溶液与D反应的离子方程式为:Al3++3NH3H2O=Al(OH)3↓+3NH4+ , 所以答案是:Al3++3NH3H2O=Al(OH)3↓+3NH4+;
②F溶液与NaOH溶液共热反应的化学方程式为:NH4Cl+NaOH ![]() NaCl+NH3↑+H2O,
NaCl+NH3↑+H2O,
所以答案是:NH4Cl+NaOH ![]() NaCl+NH3↑+H2O;(3)①AlCl3溶液中铝离子水解:Al3++3H2OAl(OH)3+3H+ , 平衡水的电离平衡,溶液呈酸性,
NaCl+NH3↑+H2O;(3)①AlCl3溶液中铝离子水解:Al3++3H2OAl(OH)3+3H+ , 平衡水的电离平衡,溶液呈酸性,
所以答案是:Al3++3H2OAl(OH)3+3H+;
②NH4Cl溶液中铵根离子水解,溶液呈酸性,故溶液中离子浓度由大到小的顺序为:c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣),
所以答案是:c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣);(4)将5.4g Al的物质的量= ![]() =0.2mol,200mL 2.0mol/L某溶液中溶质的物质的量=0.2L×2mol/L=0.4mol,将Al投入该溶液中有G单质产生,且充分反应后有金属剩余,Al与稀硝酸反应没有气体单质生成,与稀硫酸、氢氧化钠、盐酸反应都生成氢气,
=0.2mol,200mL 2.0mol/L某溶液中溶质的物质的量=0.2L×2mol/L=0.4mol,将Al投入该溶液中有G单质产生,且充分反应后有金属剩余,Al与稀硝酸反应没有气体单质生成,与稀硫酸、氢氧化钠、盐酸反应都生成氢气,
由2Al~3H2SO4可知,0.2molAl完全反应消耗H2SO4 的物质的量=0.3mol<0.4mol,故Al没有剩余,
由2Al~2NaOH可知,0.2molAl完全反应消耗NaOH的物质的量=0.2mol<0.4mol,故Al没有剩余,
由2Al~6HCl可知,0.2molAl完全反应消耗HCl的物质的量=0.6mol>0.4mol,故Al有剩余,
所以答案是:D;(5)将1molN2和3molH2和及催化剂充入容积为2L的某密闭容器中进行反应,已知该反应为放热反应.平衡时,测得NH3的物质的量浓度为a mol/L,在其他条件不变的情况下,若起始时充入0.5molN2和1.5molH2达到平衡等效为在原平衡基础上体积扩大一倍,压强减小,平衡向生成氮气、氢气的方向移动,故NH3的物质的量浓度小于0.5amol/L,所以答案是:小于.