题目内容
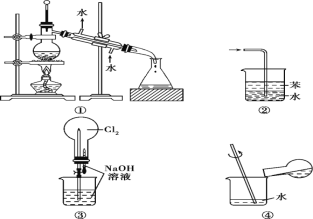
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

(1)操作①的名称是___________,操作②的名称是____________。
(2)试剂a是___________试剂b是___________,固体B是___________。(填化学式)
(3)加入试剂a所发生的离子方程式为:______________________。加入试剂b所发生的离子方程式为:_____________________。
(4)该方案能否达到实验目的:_______.若不能,应如何改进(若能,此问不用回答)
【答案】溶解 过滤 K2CO3 HCl BaCl2 Ba2++CO32-=BaCO3 BaCO3+2H+=Ba2++CO2↑+H2O 否,应在滤液中加入过量盐酸后再蒸发结晶
【解析】
分离KCl和BaCl2两种固体混合物,可将混合物先溶于水,然后加入过量K2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸溶解生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,滤液中含有氯化钾和K2CO3,可以加入过量盐酸除去碳酸钾,再经过蒸发结晶得到氯化钾晶体。据此分析解答。
(1)操作①是将固体配成溶液,应加水溶解,操作②为固体和液体的分离,为过滤,故答案为:溶解;过滤;
(2)固体溶解后加入过量K2CO3使BaCl2转化为沉淀,过滤后沉淀中加入盐酸将碳酸钡转化为BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,
故答案为:K2CO3;HCl;BaCl2;
(3)加入试剂a,K2CO3与BaCl2反应生成BaCO3沉淀,发生的离子方程式为CO32-+Ba2+=BaCO3↓,加入试剂b,BaCO3沉淀与盐酸可生成BaCl2溶液,反应的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,故答案为:CO32-+Ba2+=BaCO3↓;BaCO3+2H+=Ba2++CO2↑+H2O;
(4)滤液为KCl和K2CO3的混合物,直接蒸发结晶得到的固体C中会混入碳酸钾杂质,因此蒸发结晶前应加入适量稀盐酸,将过量的碳酸钾转化成氯化钾,故答案为:否,在应滤液中加入过量盐酸后再蒸发结晶。

 每课必练系列答案
每课必练系列答案【题目】下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合只有
序号 | X | Y | Z | W |
|
① | Cu | CuSO4 | Cu(OH)2 | CuO | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.①②③B.①③④C.②③D.①④