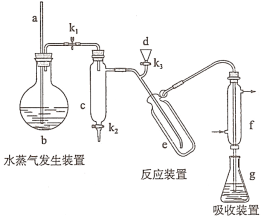
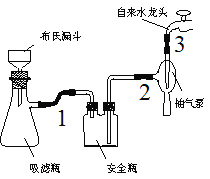
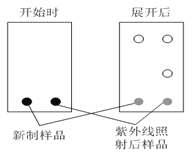
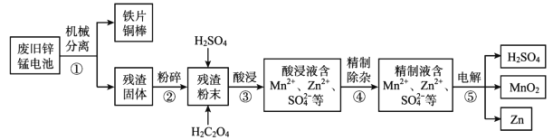
题目内容
【题目】下表是元素周期表的一部分,W、X、Y、Z 为短周期主族元素。Z 的最高价氧化物对应的水化物为 M,室温下,0. 01 mol/L M 溶液 pH<2。下列说法中错误的是
W | X | ||
Y | Z |
A.原子半径大小:X<W<YB.Z 的单质易溶于化合物 WZ2
C.气态氢化物稳定性:W<XD.含 Y 元素的离子一定是阳离子
【答案】D
【解析】
根据元素在周期表位置关系,四种元素位于第二三周期,且Z 的最高价氧化物对应的水化物为 M,室温下,0. 01 mol/L M 溶液 pH<2。则Z为S,W、X、Y分别为C、N、Al。
A.原子半径大小:N<C<Al,故A正确;
B.Z元素为S,其单质易溶于CS2,故B正确;
C.W、X分别为C、N,非金属性越强,气态氢化物的稳定性越强,非金属性:C<N,则气态氢化物稳定性:CH4<NH3,故C正确;
D.Y为Al元素,含Al元素的离子有Al3+、AlO![]() 或[Al(OH)4]-,故D错误;
或[Al(OH)4]-,故D错误;
答案选D。

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
【题目】2019年是元素周期表诞生150周年,元素周期表在学习、研究和生产实践中有很重要的作用。①~⑥六种元素在元素周期表中的位置如下:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ |
请回答下列问题:
(1)⑥的元素符号为___________。
(2)由①③④形成的化合物是一种强碱,其化学式____________。
(3)由①②形成的最简单化合物的分子模型为_____________(填序号)
(4)⑤和⑥两种元素的最高价氧化物对应的水化物之间反应的离子方程式为________________________________。