题目内容
【题目】废旧锌锰电池含有锌、锰元素,主要含有ZnO、ZnMn2 O4、MnO、Mn2 O3、Mn3 O4、MnO2。利用废旧锌锰电池回收锌和制备二氧化锰、硫酸的工艺流程如图:
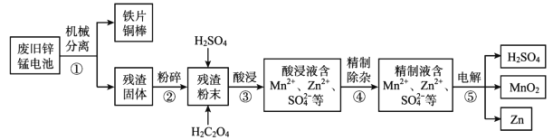
回答下列问题:
(1)步骤②“粉碎”的主要目的是______。
(2)步骤③“酸浸”发生了一系列反应:
ZnO+ H2SO4= ZnSO4 + H2O;MnO+ H2SO4= MnSO4 + H2O;
ZnMn2O4+2H2SO4=ZnSO4 + MnSO4 +2H2O+MnO2;
MnO2 + H2SO4 + H2C2O4=MnSO4 + 2CO2 ↑+2H2O。
推测 Mn2O3 与硫酸反应的离子方程式为______。
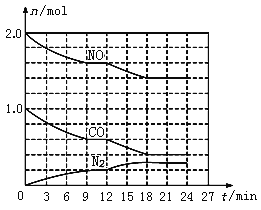
(3)如图分别表示“酸浸”时选用不同浓度硫酸和草酸对 Zn、Mn 浸出率的影响。
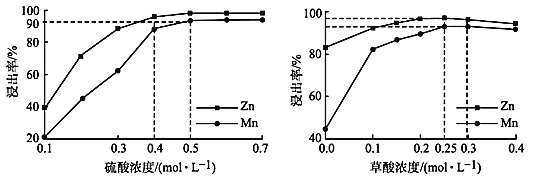
①为保证 Zn、Mn 的浸出率均大于 90%,步骤③需控制的 c(H2SO4) = ____mol/L。H2C2O4 浓度对 Mn 的浸出率影响程度大于 Zn,其原因是_____。
②假设“酸浸”所得溶液中Zn2+、Mn2+浓度相等。当 c(H2C2O4)>0.25 mol/L 时,Zn、Mn 的浸出率反而下降、且Zn 的浸出率下降先于Mn,其原因可能是_____(填序号)。
a.随着反应进行 c(H+)降低
b.Zn2+、Mn2+与 C2O42- 生成沉淀
c.溶解度:ZnC2O4<MnC2O4
(4)步骤⑤用惰性电极电解 ZnSO4 、MnSO4 的混合溶液,除生成 Zn、MnO2、H2SO4 外, 还可能生成 H2、O2 或其混合物。
①生成 MnO2 的电极反应式为_____ 。
②若 n (H2) :n (O2)=2:1,则参加反应的 n (Zn2+):n (Mn2+) = ______。
③该工艺流程中可循环利用的物质是________。
【答案】增大接触面积,提高浸出率 Mn2O3 +2H+=Mn2++H2O+ MnO2 0.5 Zn元素浸出时不需要还原剂,而+4价Mn (MnO2、Mn2O3、Mn3O4)需加入H2C2O4作还原剂更有利浸出或MnO2+H2SO4+H2C2O4=MnSO4+2CO2↑+2H2O a、b、c Mn2+ +2H2O-2e-=MnO2 +4H+ 1∶1 H2SO4或硫酸
【解析】
将废旧锌锰电池机械分离,为增加浸出率,对内部固体残渣(主要含有ZnO、ZnMn2 O4、MnO、Mn2 O3、Mn3 O4、MnO2)粉碎,加入足量H2SO4和草酸对残渣进行溶浸,发生ZnO+ H2SO4= ZnSO4 + H2O;MnO+ H2SO4= MnSO4 + H2O;ZnMn2O4+2H2SO4=ZnSO4 + MnSO4 +2H2O+MnO2;MnO2 + H2SO4 + H2C2O4=MnSO4 + 2CO2 ↑+2H2O等一系列反应,得到主要含有Mn2+、Zn2+、SO42-等离子的酸浸液,对酸浸液过滤除杂精制,对含有Mn2+、Zn2+、SO42-等离子的精制液电解得到硫酸、二氧化锰、单质锌,据此分析解答。
(1)增大接触面积,提高浸出率;
(2)ZnMn2O4可用氧化物的形式表示ZnO · Mn2O3,ZnO·Mn2O3 +2H2SO4=ZnSO4+ MnSO4+2H2O+ MnO2可知Mn2O3 +2H+=Mn2++H2O+ MnO2;
(3)①由图可知,当c(H2SO4)=0.5 mol/L时,Mn的浸出率等于90%,Zn的浸出率大于90%。由ZnO+H2SO4=ZnSO4+H2O、MnO+H2SO4=MnSO4+ H2O、ZnMn2O4 + 2H2 SO4=ZnSO4 + MnSO4+2H2O + MnO2、MnO2 + H2SO4 + H2C2O4=MnSO4+2CO2↑+2H2O可知,Zn的浸出只需H2SO4即可,所以Zn元素浸出时不需要还原剂,而+4价Mn(MnO2、Mn2O3、Mn3O4)需加入H2C2O4作还原剂更有利Mn的浸出。或MnO2 + H2SO4+H2C2O4=MnSO4+2CO2↑+2H2O;
②a.结合①的分析,Mn、Zn的浸出率与c(H+ )有关,如果c(H+)减小,浸出率下降,故a正确;
b.c(H2C2O4)>0.25mol/L时,如果Zn2+、Mn2+与C2O![]() 生成沉淀,浸出率下降,故b正确;
生成沉淀,浸出率下降,故b正确;
c.如果溶解度ZnC2O4 <MnC2O4,Zn的浸出率下降先于Mn,故c正确;
答案为:a、b、c;
(4)①根据流程,酸性条件下,Mn2+失去电子转化为MnO2,则电极反应为:Mn2+ +2H2O-2e-=MnO2 +4H+;
②阴极可能发生的电极反应为Zn2++2e-=Zn,2H++2e-=H2。阳极可能发生的电极反应为Mn2+ +2H2O-2e-=MnO2 +4H+,4OH―― 4e-=2H2O+O2。当n(H2):n(O2)=2:1时电子转移恰好相等,即电极反应Zn2++2e-=Zn与Mn2+-2e-+2H2O=MnO2 +4H+转移电子数相等,参加反应的n(Zn2+):n(Mn2+ )=1:1;
③该工艺流程中可循环利用的物质是H2SO4或硫酸。