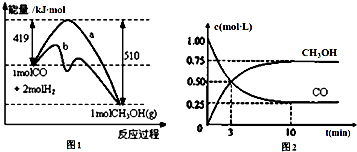
��Ŀ����
16��ij��Һ�к�Na+��Cl-��SO${\;}_{4}^{2-}$��NO${\;}_{3}^{-}$�������ӣ�����H+��0H-���ԣ���Ϊʵ�������ӷ��룬ijС��ͬѧ���ʵ�����½�����ת��Ϊ��Ӧ�ij��������ʴ��������⣺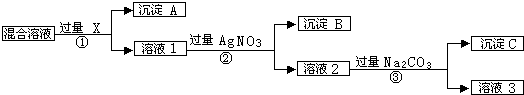
��1���Լ�XΪBaCl2��Ba��NO3��2��д��ѧʽ��������SO${\;}_{4}^{2-}$��A��������ͼ�����ֻ��ţ���ͬ���У�NO${\;}_{3}^{-}$����Һ3�У�
��2�������Т��з�����Ӧ�����ӷ���ʽΪBa2++CO32-=BaCO3����2Ag++CO32-=Ag2CO3����
��3������Һ3�м�������������ɳ�ȥ���е��������ӣ�����Һ3�ľ������������������ᾧ��
���� ʵ���ҷ���Cl-��SO42-����NO3-�����ڻ�����м���BaCl2��Ba��NO3��2������BaSO4������������ӦΪBa2++SO42-=BaSO4����Ȼ����������AgNO3����AgCl��������Ӧ�����ӷ���ʽΪCl-+Ag+=AgCl���������������Na2CO3��ʹ��Һ�е�Ag+��Ba2+��ȫ����������֮����ϡHNO3��Һ�Ӷ��õ�NaNO3���Դ˽����⣮
��� �⣺ʵ���ҷ���Cl-��SO42-����NO3-�����ڻ�����м���BaCl2��Ba��NO3��2������BaSO4������������ӦΪBa2++SO42-=BaSO4����Ȼ����������AgNO3����AgCl��������Ӧ�����ӷ���ʽΪCl-+Ag+=AgCl���������������Na2CO3��ʹ��Һ�е�Ag+��Ba2+��ȫ����������֮����ϡHNO3��Һ�Ӷ��õ�NaNO3��
��1�������Ϸ�����֪��XΪBaCl2��Ba��NO3��2��AΪBaSO4����SO42-������A�У���Һ3ΪNaNO3����NO3-��������Һ3�У��ʴ�Ϊ��BaCl2��Ba��NO3��2��A����Һ3��
��2�������Т��м��������Na2CO3��ʹ��Һ�е�Ag+��Ba2+��ȫ������������Ӧ�����ӷ���ʽΪBa2++CO32-=BaCO3����2Ag++CO32-=Ag2CO3����
�ʴ�Ϊ��Ba2++CO32-=BaCO3����2Ag++CO32-=Ag2CO3����
��3�������������Na2CO3��ʹ��Һ�е�Ag+��Ba2+��ȫ����������֮����ϡHNO3��Һ�Ӷ��õ�NaNO3��Ȼ�������ᾧ�ɵõ�NaNO3���壬
�ʴ�Ϊ����������ᾧ��
���� ���⿼�����ʵķ����ᴿ��������Ŀ�Ѷ��еȣ�����ע��Cl-��SO42-�����ʣ����ճ���ԭ���ᴿʱ���������µ����ʣ�ע�����ʵ����Ⱥ�˳��

 ����ˮ�Ǻϳ�ϩ���ij��÷�����ʵ���Һϳɻ���ϩ�ķ�Ӧ��ʵ��װ�ã��г�װ������ȥ�����¿����õ����й��������£�
����ˮ�Ǻϳ�ϩ���ij��÷�����ʵ���Һϳɻ���ϩ�ķ�Ӧ��ʵ��װ�ã��г�װ������ȥ�����¿����õ����й��������£�| ��Է������� | �ܶȣ�g•cm-3�� | �е㣨�棩 | �ܽ��� | |
| ���Ѵ� | 100 | 0.9618 | 161 | ����ˮ |
| ����ϩ | 82 | 0.8102 | 83 | ������ˮ |
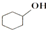 $��_{��}^{ŨH_{2}SO_{4}}$
$��_{��}^{ŨH_{2}SO_{4}}$ +H2O����a�м���20g���Ѵ���2СƬ��Ƭ����ȴ��������������1mLŨ���ᣮB��ͨ����ȴˮ��ʼ��������a�������������¶Ȳ�����90�森
+H2O����a�м���20g���Ѵ���2СƬ��Ƭ����ȴ��������������1mLŨ���ᣮB��ͨ����ȴˮ��ʼ��������a�������������¶Ȳ�����90�森�����ᴿ��
��Ӧ�ֲ��ﵹ���Һ©���зֱ�������5%̼������Һ��ˮϴ�ӣ�����������ˮ�Ȼ��ƿ���������һ��ʱ�����ȥ�Ȼ��ƣ�����ͨ������õ���������ϩ10g��
�ش��������⣺
��1��װ��b�������������ܣ�
��2���������Ƭ�������Ƿ�ֹ���У��������һ��ʱ��������ǼӴ�Ƭ��Ӧ�ò�ȡ����ȷ������B������ȷ�𰸳ƺţ���
A����������B����ȴ��C�����貹��D����������
��3����Һ©����ʹ��ǰ����ϴ�ɾ�����©���ڱ�ʵ���������У�����Ӧ�ôӷ�Һ©�����Ͽڵ�������Ͽڵ��������¿ڷų�������
��4�������ᴿ�����м�����ˮ�Ȼ��Ƶ�Ŀ���Ǹ��
| A�� | ���³�ѹ��64g SO2������ԭ����Ϊ1NA | |
| B�� | ���ʵ���Ũ��Ϊ0.5mol•L-1��MgCl2��Һ������Cl-��Ϊ1NA | |
| C�� | ��״���£�11.2LSO3���е�ԭ����ĿΪ2NA | |
| D�� | �κ������£�0.5mol N2���з�����һ����0.5NA |
| ������ | ��ԭ�� | ������Ӧ�� | �������� | ��ԭ���� | |
| �� | Cl2 | FeBr2 | Cl- | ||
| �� | KClO | Ũ���� | Cl2 | ||
| �� | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A�� | �ڢ���ķ�Ӧ����Cl2��FeBr2���ʵ���֮�ȡ�1��2ʱ��ֻ��һ��Ԫ�ر����� | |
| B�� | �ڢ�����ʵ�����Ʋ⣺ClO-��Cl-��������Һ�д������� | |
| C�� | ������ǿ���ıȽϣ�KClO��Cl2 | |
| D�� | �ڢ��鷴Ӧ�����ӷ���ʽΪ��2MnO4-+3H2O2+6H+�T2Mn2++4O2��+6H2O |
 1-����������һ����ɫҺ�壬�ܶȱ�ˮ������ˮ�������ڴ����ѣ��۵�5.5�棬�е�267.4�森1�����������������ϣ�Ҳ����Ϊ�ϳ��������ϵ�ԭ�ϣ�
1-����������һ����ɫҺ�壬�ܶȱ�ˮ������ˮ�������ڴ����ѣ��۵�5.5�棬�е�267.4�森1�����������������ϣ�Ҳ����Ϊ�ϳ��������ϵ�ԭ�ϣ�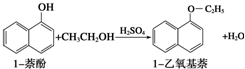
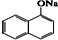 ��
��
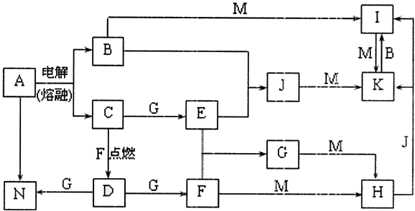
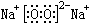 ��
��