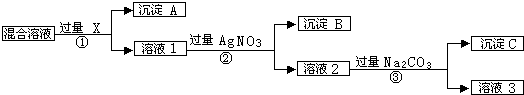
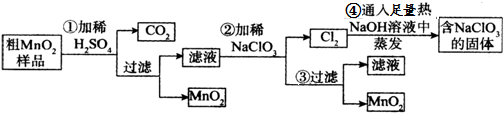
题目内容
3.根据表中信息,判断下列叙述中正确的是( )| 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 | |
| ① | Cl2 | FeBr2 | Cl- | ||
| ② | KClO | 浓盐酸 | Cl2 | ||
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 第①组的反应,当Cl2与FeBr2物质的量之比≤1:2时,只有一种元素被氧化 | |
| B. | 第②组事实可以推测:ClO-、Cl-不能在溶液中大量共存 | |
| C. | 氧化性强弱的比较:KClO<Cl2 | |
| D. | 第③组反应的离子方程式为:2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O |
分析 A.当Cl2与FeBr2物质的量之比≤1:2时,由电子守恒可知,只有亚铁离子被氧化;
B.ClO-、Cl-在酸性溶液中发生氧化还原反应;
C.由②中反应可知,氧化剂的氧化性大于氧化产物的氧化物;
D.电子不守恒.
解答 解:A.当Cl2与FeBr2物质的量之比≤1:2时,由电子守恒可知,只有亚铁离子被氧化,当Cl2与FeBr2物质的量之比≥1:2时溴离子才被氧化,故A正确;
B.ClO-、Cl-在酸性溶液中发生氧化还原反应,而碱性溶液中ClO-、Cl-能大量共存,故B错误;
C.由②中反应可知,氧化剂的氧化性大于氧化产物的氧化物,则氧化性为KClO>Cl2,故C错误;
D.第③组反应的离子方程式为2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,故D错误;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握氧化还原反应基本概念及规律性知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
14.有关有机物的结构,下列说法不正确的是( )
| A. | 碳碳双键不可旋转所以烯烃一定有顺反异构 | |
| B. | CH2Cl2无同分异构体可以证明CH4是正四面体的结构 | |
| C. | 邻二甲苯只有一种结构可以证明苯分子中无单双健的交替结构 | |
| D. | 乙烯、乙炔是平面型分子可推知CH3-CH=C(CH3)-C≡C-CH3分子中所有的碳原子共面 |
11.标准状况下,CO2和N2的混合气体的质量是9.6g,体积是6.72L,则CO2在混合物中的质量分数约为( )
| A. | 25% | B. | 35% | C. | 75% | D. | 50% |
18.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 常温常压下,46gNO2和N2O4混合气体含有的原子数为3NA | |
| C. | 1molCl2参加的氧化还原反应,反应过程中转移电子数都是2NA | |
| D. | 56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
15.下列反应中,离子方程式书写正确的是( )
| A. | 氢氧化钡与盐酸反应:OH-+H+=H2O | |
| B. | Fe和盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | Cu和AgNO3溶液反应:Cu+Ag+=Cu2++Ag | |
| D. | 石灰石和醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
12.NA表示阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 常温常压下,22.4L CO2中含有 NA个CO2分子 | |
| B. | O2、O3混合气体48g共含有O原子数为3NA个 | |
| C. | 等物质的量的N2和CO所含分子数均为NA | |
| D. | 1 mol K2SO4溶于水,所得溶液中K+的数目为2NA |
12.下列说法中不正确的是( )
| A. | 需要加热才能发生的反应可能是吸热反应也可能是放热反应 | |
| B. | 1 mol强酸与1mol强碱发生中和反应所放出的热量叫做中和热 | |
| C. | 可逆反应2SO2+O2?2SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,Qc变小,K不变,O2转化率减小 | |
| D. | 催化剂表面做成蜂窝状更有利于提高催化效果 |