题目内容
室温下浓度为0.01mol/L的三种一元酸溶液:HA、HB、HC,其中HA的c(H+)=0.001mol/L,HB的电离度为0.1%,HC的c(OH-)=1×10-12mol/L,则室温下三种酸所形成的钠盐:NaA、NaB、NaC的溶液在物质的量浓度相同的情况下,其pH值由大到小的顺序是( )
| A、NaA>NaB>NaC |
| B、NaB>NaA>NaC |
| C、NaB>NaC>NaA |
| D、NaC>NaA>NaB |
考点:盐类水解的应用,弱电解质在水溶液中的电离平衡
专题:盐类的水解专题
分析:室温下浓度为0.01mol/L的三种一元酸溶液:HA、HB、HC,其中HA的c(H+)=0.001mol/L,HB的电离度为0.1%,则HB中c(H+)=0.01mol/L×0.1%=10-5 mol/L,HC的c(OH-)=1×10-12mol/L,HC中c(H+)=
=0.01mol/L,则HC完全电离,为强酸,HA、HB为弱酸,且HA的酸性大于HB,酸的酸性越强,其酸根离子水解程度越小,则相同浓度的钠盐溶液的pH越小,据此分析解答.
| 10-14 |
| 10-12 |
解答:
解:室温下浓度为0.01mol/L的三种一元酸溶液:HA、HB、HC,其中HA的c(H+)=0.001mol/L,HB的电离度为0.1%,则HB中c(H+)=0.01mol/L×0.1%=10-5 mol/L,HC的c(OH-)=1×10-12mol/L,HC中c(H+)=
=0.01mol/L,则HC完全电离,为强酸,HA、HB为弱酸,且HA的酸性大于HB,所以酸性HC>HA>HB,酸的酸性越强,其酸根离子水解程度越小,则相同浓度的钠盐溶液的pH越小,所以酸根离子水解程度B->A-,则室温下三种酸所形成的钠盐:NaA、NaB、NaC的溶液在物质的量浓度相同的情况下,其pH值由大到小的顺序是NaB>NaA>NaC,故选B.
| 10-14 |
| 10-12 |
点评:本题考查了盐类水解,明确酸的酸性强弱与酸根离子水解程度关系及酸根离子水解程度与溶液pH的关系是解本题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于油脂和乙酸乙酯的比较中,正确的是( )
| A、油脂和乙酸乙酯都是纯净物,在室温下都是液体 |
| B、油脂和乙酸乙酯都能水解生成羧酸和醇 |
| C、油脂和乙酸乙酯都不能使溴水褪色 |
| D、油脂和乙酸乙酯都不溶于水,而易溶于有机溶剂 |
化学反应经常伴随着颜色变化,下列有关反应的颜色变化正确的是( )
①淀粉溶液遇单质碘-蓝色;②苯酚在空气中氧化-粉红色;③溴化银见光分解-白色;④热的氢氧化铜遇乙醇-绿色;⑤新制氯水久置后-无色.
①淀粉溶液遇单质碘-蓝色;②苯酚在空气中氧化-粉红色;③溴化银见光分解-白色;④热的氢氧化铜遇乙醇-绿色;⑤新制氯水久置后-无色.
| A、①②⑤ | B、②④⑤ |
| C、①②④ | D、②③⑤ |
下列说法正确的是( )
| A、淀粉、蛋白质、油脂都是天然高分子化合物 |
| B、能与氢气发生加成反应的烃中一定含有碳碳双键 |
| C、煤的干馏、石油分馏、石油裂化都生成了新物质,都属于化学变化 |
| D、天然气、沼气、水煤气分别属于化石能源、可再生能源和二次能源 |
分子式为C4H8Cl2,含有两个甲基的同分异构体共有(不考虑立体异构)( )
| A、3种 | B、5种 | C、4种 | D、6种 |
下列每组中的两种互为同素异形体的是( )
| A、金刚石与石墨 |
| B、CH4与CH3CH3 |
| C、正丁烷与异丁烷 |
| D、12C与14C |
将CO2通入下列溶液中,一定不会产生沉淀的是( )
| A、澄清的石灰水 |
| B、氯化钡溶液 |
| C、饱和碳酸钠溶液 |
| D、偏铝酸钠溶液 |
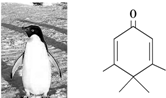 如右图所示的分子酷似企鹅,化学家将该分子以企鹅来取名为Penguinone.下列有关说法错误的是( )
如右图所示的分子酷似企鹅,化学家将该分子以企鹅来取名为Penguinone.下列有关说法错误的是( )| A、Penguinone分子式为C10H14O |
| B、Penguinone是一种芳香族化合物 |
| C、Penguinone可以使酸性高锰酸钾溶液褪色 |
| D、Penguinone能与H2发生加成反应 |