题目内容
14.现有标准状况下11.2LSO2和32gO3,则SO2与O3的物质的量之比为3:4,所含氧原子数之比为1:2.分析 根据n=$\frac{V}{{V}_{m}}$计算SO2的物质的量,根据n=$\frac{m}{M}$计算O3的物质的量,结合分子含有氧原子数目计算O原子物质的量之比.
解答 解:标准状况下11.2LSO2的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,32gO3的物质的量为$\frac{32g}{48g/mol}$=$\frac{2}{3}$mol,
故SO2与O3的物质的量之比为0.5mol:$\frac{2}{3}$mol=3:4,所含氧原子数之比为3×2:4×3=1:2,
故答案为:3:4;1:2.
点评 本题考查物质的量有关计算,比较基础,有利于基础知识的巩固.

练习册系列答案
相关题目
5.对于密闭容器中进行的反应N2+O2?2NO,下列条件能加快其反应速率的是( )
| A. | 增大体积使压强减小 | B. | 体积不变,充入N2使压强增大 | ||
| C. | 体积不变,充入He使压强增大 | D. | 体积不变,充入气体Ne |
2.下列说法不正确的是( )
| A. | 氧化还原反应的特征是元素化合价发生了变化 | |
| B. | 在水溶液中能电离出H+的化合物不一定是酸 | |
| C. | 溶液与胶体的本质区别是能否产生丁达尔现象 | |
| D. | 因为NH3溶于水的溶液能导电,所以NH3是电解质 |
9.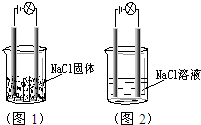 一化学兴趣小组在家中进行化学实验,按照图1连接 好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
一化学兴趣小组在家中进行化学实验,按照图1连接 好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
 一化学兴趣小组在家中进行化学实验,按照图1连接 好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
一化学兴趣小组在家中进行化学实验,按照图1连接 好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )| A. | NaCl是非电解质 | |
| B. | 将图2中的NaCl溶液换成液态HCl,灯泡也亮 | |
| C. | 将图2中的NaCl溶液换成SO2的水溶液,灯泡也亮,说明SO2是电解质 | |
| D. | 电解质本身不一定能导电 |
19.如果花生油中混有水,最好的分离方法是( )
| A. | 过滤 | B. | 蒸馏 | C. | 分液 | D. | 萃取 |
4.设NA为阿伏伽德罗常数的数值,下列叙述正确的是( )
| A. | 0.1mol•L-1的NaCl溶液中Cl-的数目为0.1NA | |
| B. | 16g O3中所含的氧原子数为NA | |
| C. | 22.4L H2中含有的氢原子数一定为2NA | |
| D. | 1mol Cl2与过量的金属钠充分反应后,转移的电子数为NA |