题目内容
4.书写下列物质的电离方程式碳酸钡BaCO3=Ba2++CO32-;
碳酸氢钠NaHCO3═Na++HCO3-;
次氯酸HClO H++ClO-;
氢氧化铜Cu(OH)2 Cu2++2OH-;
氢硫酸H2S H++HS-.
分析 电离方程式书写原则:是能溶于水的强电解质完全电离,用等号,能溶于水的弱电解质存在电离平衡用用可逆号?,多元弱酸分步电离,多元弱碱分步电离,但是书写时一步到位,据此解答.
解答 解:碳酸钡是强电解质,完全电离,电离方程式:BaCO3=Ba2++CO32-;
故答案为:BaCO3=Ba2++CO32-;
碳酸氢钠为强电解质,在水溶液中电离生成钠离子和碳酸氢根离子,电离方程式:NaHCO3═Na++HCO3-;
故答案为:NaHCO3═Na++HCO3-;
次氯酸为弱电解质,水溶液中部分电离出氢离子和次氯酸根离子,电离方程式:HClO H++ClO-;
故答案为:HClO H++ClO-;
氢氧化铜为弱电解质,部分电离产生铜离子和氢氧根离子,电离方程式:Cu(OH)2 Cu2++2OH-;
故答案为:Cu(OH)2 Cu2++2OH-;
氢硫酸为多元弱酸,分步电离,以第一步为主,电离方程式:H2S H++HS-;
故答案为:H2S H++HS-.
点评 本题考查了电离方程式的书写方法和注意问题,准确判断强弱电解质是解题关键,注意多元弱酸、多元弱碱的书写方式.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列叙述中正确的是( )
①Na2O和Na2O2都能和水反应生成碱,它们都是碱性氧化物 ②Na2CO3和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀 ③钠在常温下不容易被氧化 ④Na2O2可作供氧剂,而Na2O不行 ⑤除去Na2CO3固体中混有的NaHCO3,将混合物加热至质量不再发生变化 ⑥可用玻璃棒蘸取少量待测物质的浓溶液做焰色反应实验.
①Na2O和Na2O2都能和水反应生成碱,它们都是碱性氧化物 ②Na2CO3和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀 ③钠在常温下不容易被氧化 ④Na2O2可作供氧剂,而Na2O不行 ⑤除去Na2CO3固体中混有的NaHCO3,将混合物加热至质量不再发生变化 ⑥可用玻璃棒蘸取少量待测物质的浓溶液做焰色反应实验.
| A. | ②③④⑤ | B. | ④⑤ | C. | ②④⑥ | D. | ①②⑥ |
12.X、Y是元素周期表ⅦA族中的两种元素.下列叙述中能说明X的非金属性比Y强的是( )
| A. | X的气态氢化物比Y的气态氢化物稳定 | |
| B. | X的氢化物的沸点比Y的氢化物的沸点低 | |
| C. | X原子的电子层数比Y原子的电子层数多 | |
| D. | Y的单质能将X从NaX的溶液中置换出来 |
9.2007年3月21日,全国科学技术名词审定委员会公布:111号元素的中文名称为錀(Rg),以此纪念科学家伦琴诞辰111周年.有关272Rg的叙述正确的是( )
| A. | 272Rg的质子数为272 | |
| B. | 272Rg原子的中子数与电子数之差为50 | |
| C. | 272Rg 原子核内有111个中子 | |
| D. | 第111号元素位于元素周期表第6周期 |
 可简写为
可简写为  .降冰片烯的分子结构可表示为
.降冰片烯的分子结构可表示为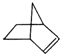
 .
.
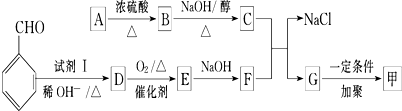
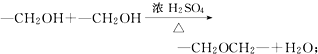

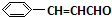 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2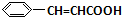 +H2O;
+H2O;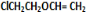 +
+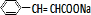 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$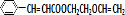 +NaCl.
+NaCl.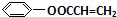 .
.