题目内容
【题目】由于石油资源有限,且汽油燃烧会产生严重的污染,未来将用氢气作为燃料来取代汽油,生产21世纪环保汽车。已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1;H2O(l)=H2O(g) ΔH=+44kJ·mol-1
(1)写出氢气和氧气反应生成液态水的热化学方程式:____。
(2)若要得到857.4kJ的热量,至少需氢气的质量为____,这些氢气在标准状况下的体积为____。
(3)合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) ΔH
CO2(g)+4H2(g) ΔH
反应过程中能量变化如图所示,则该反应为反应____(填“吸热”或“放热”)

若已知,破坏1mol化学键需要吸收的热量如下表所示:
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | a | b | c | d |
则该反应的ΔH为_____(用含a、b、c、d字母的代数式表示)。
【答案】2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol 6g 67.2L 吸热 4a+4b2c4d
【解析】
(1)在25℃,100kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热,单位为kJ/mol;写出氢气与氧气反应生成液态水的化学方程式,根据盖斯定律,结合反应①②计算氢气与氧气反应生成液态水的反应热;
(2)根据物质的量与反应热成正比,结合热化学方程式进行计算;
(3)图象分析可知反应物能量低于生成物,反应为吸热反应,化学反应吸收的热量=反应物键能总和-生成物键能总和。
(1)①2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,
②H2O(l)=H2O(g)△H=+44kJ/mol,
依据盖斯定律①-②×2得到:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol;
(2)在通常情况下,若要得到857.4kJ的热量,则需要氢气的的物质的量为: =3mol,需H2的质量=3mol×2g/mol=6g;这些H2在标况下的体积=3mol×22.4L/mol=67.2L;
=3mol,需H2的质量=3mol×2g/mol=6g;这些H2在标况下的体积=3mol×22.4L/mol=67.2L;
(3)反应过程中能量变化分析可知,反应物能量低于生成物,反应为吸热反应;CH4(g)+2H2O(g)![]() CO2(g)+4H2(g),ΔH=(4a+4b)-(2c+4d)=4a+4b2c4d。
CO2(g)+4H2(g),ΔH=(4a+4b)-(2c+4d)=4a+4b2c4d。

【题目】高炉炼铁过程中发生反应: ![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
温度T/℃ | 1000 | 1150 | 1300 |
平衡常数K | 4.0 | 3.7 | 3.5 |
A. 由表中数据可判断该反应:反应物的总能量<生成物的总能量
B. 1000℃下Fe2O3与CO反应,t min达到平衡时c(CO) =2×10-3 mol/L,则用CO2表示该反应的平均速率为2×10-3/t mol·L-1·min-1
C. 为了使该反应的K增大,可以在其他条件不变时,增大c(CO)
D. 其他条件不变时,增加Fe2O3的用量,不能有效降低炼铁尾气中CO的含量
【题目】将铁粉和铜粉的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO)。下列计算结果正确的是
编号 | ① | ② | ③ | ④ |
硝酸体积/mL | 100 | 200 | 300 | 400 |
剩余金属/g | 18.0 | 9.6 | 0 | 0 |
NO体积/L | 2.24 | 4.48 | 6.72 | V |
A. ①中溶液存在Fe3+ B. 硝酸的浓度为4mol/L
C. ②中溶解了9.6gCu D. ④中V=6.72
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
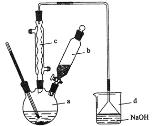
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按以下合成步骤回答问题:
(1)在a中加入15 mL苯和少量铁屑。在b中小心加入4.0 mL 液溴。再将b中液溴慢慢加入到a中,充分反应。装置a中发生的主要反应是___;装置d的作用是___。
(2)反应过程中,a外壁温度升高,为提高原料利用率,采取以下措施:
①采用装置c的目的是___。
②利用温度计控制温度,适宜的温度范围为(填序号)___。
A.>156℃ B. 59℃-80℃ C.<59℃
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。操作②所需要的玻璃仪器除烧杯外,还需___,滤液用NaOH溶液洗涤的作用是___。
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
(4)经过上述分离操作后,粗溴苯中溶解的主要杂质为苯,要进一步提纯,下列操作中必须的是___(填入正确选项前的字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取