题目内容
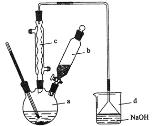
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按以下合成步骤回答问题:
(1)在a中加入15 mL苯和少量铁屑。在b中小心加入4.0 mL 液溴。再将b中液溴慢慢加入到a中,充分反应。装置a中发生的主要反应是___;装置d的作用是___。
(2)反应过程中,a外壁温度升高,为提高原料利用率,采取以下措施:
①采用装置c的目的是___。
②利用温度计控制温度,适宜的温度范围为(填序号)___。
A.>156℃ B. 59℃-80℃ C.<59℃
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。操作②所需要的玻璃仪器除烧杯外,还需___,滤液用NaOH溶液洗涤的作用是___。
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
(4)经过上述分离操作后,粗溴苯中溶解的主要杂质为苯,要进一步提纯,下列操作中必须的是___(填入正确选项前的字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
【答案】![]() +Br2
+Br2 ![]() +HBr 吸收HBr(Br2),并能防倒吸 冷凝、回流、(导气) C 分液漏斗 除去溶解的Br2(HBr) C
+HBr 吸收HBr(Br2),并能防倒吸 冷凝、回流、(导气) C 分液漏斗 除去溶解的Br2(HBr) C
【解析】
(1)苯与液溴在溴化铁的作用下发生反应生成溴苯和溴化氢;溴化氢易溶于水,则装置的作用为吸收HBr(Br2),并能防倒吸;
(2)①装置c为球形冷凝管,反应为放热反应,可导致溴挥发;
②溴的沸点为59℃,为减少溴的损失,应控制温度小于59℃;
(3)生成的溴苯、未反应的苯、溴均不溶于水,分离水层与油状物质用分液漏斗分离;溴可与NaOH反应生成溴化钠、次溴酸钠和水,除去溶解的Br2和HBr;
(4)苯与溴苯为相互溶解的液体,其沸点差距较大,可用蒸馏的方法分离。
(1)苯与液溴在溴化铁的作用下发生反应生成溴苯和溴化氢,方程式为![]() +Br2
+Br2 ![]() +HBr;溴化氢易溶于水,则装置的作用为吸收HBr(Br2),并能防倒吸;
+HBr;溴化氢易溶于水,则装置的作用为吸收HBr(Br2),并能防倒吸;
(2)①装置c为球形冷凝管,反应为放热反应,可导致溴挥发,而装置c可使溴蒸气冷凝、回流,也可使生成的HBr气体流出;
②溴的沸点为59℃,为减少溴的损失,应控制温度小于59℃,答案为C;
(3)生成的溴苯、未反应的苯、溴均不溶于水,分离水层与油状物质用分液漏斗分离;溴可与NaOH反应生成溴化钠、次溴酸钠和水,除去溶解的Br2和HBr;
(4)苯与溴苯为相互溶解的液体,其沸点差距较大,可用蒸馏的方法分离,答案为C。

 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】由于石油资源有限,且汽油燃烧会产生严重的污染,未来将用氢气作为燃料来取代汽油,生产21世纪环保汽车。已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1;H2O(l)=H2O(g) ΔH=+44kJ·mol-1
(1)写出氢气和氧气反应生成液态水的热化学方程式:____。
(2)若要得到857.4kJ的热量,至少需氢气的质量为____,这些氢气在标准状况下的体积为____。
(3)合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) ΔH
CO2(g)+4H2(g) ΔH
反应过程中能量变化如图所示,则该反应为反应____(填“吸热”或“放热”)

若已知,破坏1mol化学键需要吸收的热量如下表所示:
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | a | b | c | d |
则该反应的ΔH为_____(用含a、b、c、d字母的代数式表示)。