题目内容
3.焦硫酸(H2SO4•SO3)溶于水,其中SO3都转化为硫酸.若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为1.25mol/L.分析 根据焦硫酸(H2SO4•SO3)溶于水,其中SO3都转化为硫酸,即n(H2SO4)=2n(H2SO4•SO3),结合公式c=$\frac{n}{V}$来求硫酸的物质的量浓度.
解答 解:n(H2SO4)=2n(H2SO4•SO3)=$\frac{445g}{178g/mol}$×2=5mol,所以该硫酸的物质的量浓度为c(H2SO4)=$\frac{5mol}{4.00L}$=1.25mol/L,
故答案为:1.25.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式即可解答,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.已知核内中子数为N的R2+离子,质量数为A,则n g它的氧化物中含质子的物质的量是( )
| A. | (A-N+2)mol | B. | $\frac{n(A-N+10)}{A+16}$mol | C. | $\frac{n(A-N+8)}{A+16}$mol | D. | $\frac{n(A-N+16)}{A}$mol |
14.下表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ).
根据上述数据回答题:
(1)下列物质本身具有的能量最高的是D (填A.B.C.D)
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中,最稳定的是A (填A.B.C.D),若无上表中的数据,你能正确回答出此问题吗?能(填能、否)你的根据是元素非金属性越强,形成的气态氢化物越稳定.
A.HF B.HCl C.HBr D.HI
(3)X2+H2=2HX(X代表Cl、Br、I)的反应是放热反应(填“吸热”或“放热”)
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是氯气(填写分子式).
| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
| 能量 | 243 | 193 | 151 | 436 | 568 | 432 | 366 | 298 |
(1)下列物质本身具有的能量最高的是D (填A.B.C.D)
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中,最稳定的是A (填A.B.C.D),若无上表中的数据,你能正确回答出此问题吗?能(填能、否)你的根据是元素非金属性越强,形成的气态氢化物越稳定.
A.HF B.HCl C.HBr D.HI
(3)X2+H2=2HX(X代表Cl、Br、I)的反应是放热反应(填“吸热”或“放热”)
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是氯气(填写分子式).
11.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲$\stackrel{丁}{→}$乙$?_{甲}^{丁}$丙.下列有关物质的推断不正确的是( )
| A. | 若甲为焦炭,则丁可能是O2 | B. | 若甲为SO2,则丁可能是氨水 | ||
| C. | 若甲为Fe,则丁可能是盐酸 | D. | 若甲为NaOH溶液,则丁可能是CO2 |
18.可逆反应:2NO3$\stackrel{△}{?}$2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
(1)单位时间内生成nmolO2的同时生成2nmolNO2
(2)单位时间内生成nmolO2的同时,生成2nmolNO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态.
(1)单位时间内生成nmolO2的同时生成2nmolNO2
(2)单位时间内生成nmolO2的同时,生成2nmolNO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态.
| A. | (1)(4) | B. | (2)(3) | C. | (1)(3)(4) | D. | (1)(2)(3)(4) |
8.下列关于如图所示装置的说法,正确的是( )
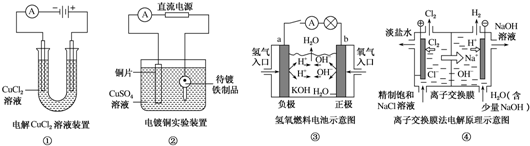

| A. | ①装置中阴极处产生的气体能够使湿润KI淀粉试纸变蓝 | |
| B. | ②装置中待镀铁制品应与电源正极相连 | |
| C. | ③装置中电子由b极流向a极 | |
| D. | ④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
15.一定质量铜和适量的浓硝酸反应,随着反应的进行,所生成的气体颜色逐渐变浅,当铜反应完毕后,共收集到11.2L气体(标况),将该气体与0.325molO2混合溶于水,恰好无气体剩余.则反应中消耗硝酸的物质的量( )
| A. | 1.2mol | B. | 1.1mol | C. | 1.8 mol | D. | 1.6mol |
 根据所学知识回答下列问题,在如图所示装置中
根据所学知识回答下列问题,在如图所示装置中