题目内容
13.已知核内中子数为N的R2+离子,质量数为A,则n g它的氧化物中含质子的物质的量是( )| A. | (A-N+2)mol | B. | $\frac{n(A-N+10)}{A+16}$mol | C. | $\frac{n(A-N+8)}{A+16}$mol | D. | $\frac{n(A-N+16)}{A}$mol |
分析 在原子中,核电荷数=质子数=核外电子数,质量数=质子数+中子数,在阳离子中,核电荷数=质子数=核外电子数+所带电荷数,核内中子数为N的R2+离子,质量数为A,所以质子数为A-N,该离子的相对原子质量在数值上等于其质量数;该离子带2个单位正电荷,所以其氧化物的化学式为RO;该氧化物的摩尔质量为(A+16)g/mol,一个氧化物分子中含有(A-N+8)个质子.
解答 解:该离子带2个单位正电荷,所以其氧化物的化学式为RO,R2+离子,质量数为A,该氧化物的摩尔质量为(A+16)g/mol,n g 它的氧化物的物质的量为$\frac{ng}{(A+16)g/mol}$;
核内中子数为N的R2+离子,质量数为A,所以质子数为A-N,一个氧化物分子中含有(A-N+8)个质子,所以ng 它的氧化物中所含质子的物质的量为$\frac{ng}{(A+16)g/mol}$×(A-N+8)mol=$\frac{n(A-N+8)}{(A+16)}$mol,
故选C.
点评 本题考查了质子数、中子数、质量数之间的关系,注意质量数在数值上等于其相对原子质量,在阳离子中,核电荷数=质子数=核外电子数+所带电荷数,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
3.实验室常利用甲醛(HCHO)法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mol (CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.
某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500g.
步骤Ⅱ将样品溶解在250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)上述操作步骤Ⅱ是否正确否(填“是”或“否”);若不正确,请改正将样品溶解在小烧杯中,冷却后转移至容量瓶中 (若正确,此空不填).
(2)根据步骤Ⅲ填空:
①该实验用的是50mL滴定管,如果液面处的读数是amL,则滴定管中液体的体积D(填代号)
A.是amL B.是(50-a)mL C.一定大于amlL D.一定大于(50-a)mlL②碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
③锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”、“偏小”或“无影响”)
④滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化.
⑤滴定达到终点时现象:溶液由无色变为粉红(或浅红)色,且半分钟内不变色.
(3)滴定结果如下表所示:
若NaOH标准溶液的浓度为0.1010mol•L-1,则该样品中氮的质量分数为18.85%.
某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500g.
步骤Ⅱ将样品溶解在250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)上述操作步骤Ⅱ是否正确否(填“是”或“否”);若不正确,请改正将样品溶解在小烧杯中,冷却后转移至容量瓶中 (若正确,此空不填).
(2)根据步骤Ⅲ填空:
①该实验用的是50mL滴定管,如果液面处的读数是amL,则滴定管中液体的体积D(填代号)
A.是amL B.是(50-a)mL C.一定大于amlL D.一定大于(50-a)mlL②碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
③锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”、“偏小”或“无影响”)
④滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化.
⑤滴定达到终点时现象:溶液由无色变为粉红(或浅红)色,且半分钟内不变色.
(3)滴定结果如下表所示:
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
4.NaH是-种离子化合物,它跟水反应的方程式为:NaH+H2O=NaOH+H2↑,它也能跟液态氨、乙醇等发生类似的反应,并都产生氢气.下列有关NaH的叙述错误的是( )
| A. | 跟水反应时,水作氧化剂 | |
| B. | NaH中H-半径比Li+半径小 | |
| C. | NaH跟液氨反应时,有NaNH2生成 | |
| D. | Na原子与H原子结合组成NaH过程中发生了电子转移. |
1.只用水就能鉴别的一组物质是( )
| A. | 苯、乙酸、四氯化碳 | B. | 乙醇、乙醛、乙酸 | ||
| C. | 乙醛、乙二醇、溴乙烷 | D. | 苯酚、乙醇、甘油 |
8.下列说法中,正确的是( )
| A. | SO2能使FeCl3、KMnO4溶液迅速褪色 | |
| B. | 可以用澄清石灰水来鉴别SO2与CO2 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| D. | 冷的浓硫酸和浓硝酸可以用铁桶装 |
2.下列关于强、弱电解质的叙述中正确的是( )
| A. | 只有强酸和强碱是强电解质,只有弱酸和弱碱是弱电解质 | |
| B. | 强电解质都是可溶性化合物,弱电解质都是难溶性化合物 | |
| C. | 易溶于水的强电解质水溶液中无溶质分子,易溶的弱电解质水溶液中有溶质分子 | |
| D. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
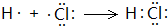
 .
.