题目内容
2.硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)?[B(OH)4]-(aq)+H+(aq).下列说法正确的是( )| 化学式 | 电离常数(298K) |
| 硼酸 | K=5.7×10-10 |
| 碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
| 醋酸 | K=1.75×10-5 |
| A. | 将一滴碳酸钠溶液滴入一硼酸溶液中一定能观察到有气泡产生 | |
| B. | 将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生 | |
| C. | 向0.2 mol•L-1 NaHCO3溶液中加入等体积的0.1 mol•L-1NaOH溶液:c(H2CO3)+c(H+)+c(HCO3-)=c(OH-)+c(CO32-) | |
| D. | 等物质的量浓度的碳酸溶液和醋酸溶液比较,pH:前者>后者 |
分析 A.根据电离常数,可以得出酸性强弱:碳酸>硼酸>HCO3-,则硼酸不会置换出二氧化碳气体;
B.由表中数据可知,酸性:醋酸>碳酸>HCO3-,则碳酸钠与醋酸反应生成碳酸氢钠;
C.反应后溶质为等浓度的碳酸钠和碳酸氢钠,根据混合液中的物料守恒和电荷守恒判断;
D.酸性:醋酸>碳酸,则等浓度的醋酸中氢离子浓度大于碳酸,氢离子浓度越大,溶液的pH越小.
解答 解:酸的电离常数越大,其酸性越强,根据电离常数知,酸性强弱顺序是:醋酸>碳酸>硼酸>HCO3-,
A.因为碳酸>硼酸>碳酸氢根离子,则碳酸钠和硼酸反应生成碳酸氢钠而不是二氧化碳,所以观察不到有气泡产生,故A错误;
B.醋酸和碳酸钠反应先生成碳酸氢钠,碳酸氢钠再和醋酸反应生成二氧化碳,则将一滴醋酸溶液滴入碳酸钠溶液中,不会生成气泡,故B错误;
C.向0.2 mol•L-1 NaHCO3溶液中加入等体积的0.1 mol•L-1NaOH溶液,反应后溶质为等浓度的碳酸钠和碳酸氢钠,根据电荷守恒可知:c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-),根据物料守恒可得:2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3),二者结合可得:3c(H2CO3)+2c(H+)+c(HCO3-)=2c(OH-)+c(CO32-),故C错误;
D.由于酸性:醋酸>碳酸,则等浓度的碳酸和醋酸溶液中,醋酸溶液中氢离子浓度较大,则其溶液pH较小,即:pH:前者>后者,故D正确;
故选D.
点评 本题考查了弱电解质的电离平衡及其影响、离子浓度大小比较,题目难度中等,根据电离平衡常数正确判断各酸的酸性大小为解答关键,注意掌握弱电解质的电离平衡及其影响因素,明确电荷守恒、物料守恒在判断离子浓度大小中的应用方法.

| A. | HClO的电子式为: | |
| B. | 硝基苯的结构简式为: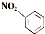 | |
| C. | 含18个中子的氯原子的核素符号:1735Cl | |
| D. | 四氯化碳分子比例模型: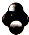 |
| A. | 以NaCl溶液或NaOH溶液为电解液时,正极反应都为O2+2H2O+4e-=4OH- | |
| B. | 以NaOH溶液为电解液时,负极反应为Al+4OH--3e-=AlO2-+2H2O | |
| C. | 以NaOH溶液为电解液时,电池在工作过程中电解液的pH增大 | |
| D. | 以NaCl溶液为电解液时,电流由空气电极沿导线流向铝合金电极 |
| A. | 25℃、101kPa下,1 g氢气燃烧生成液态水放出142.9 kJ热量,其热化学方程式为:2H2(g)+O2(g)═2H2O(l);△H=-285.8 kJ•mol-1 | |
| B. | 由水电离出的c(H+)=1×10-13mol/L的溶液中,CO32-、K+、SO42-、Cl-在溶液中可能大量存在 | |
| C. | 浓度均为0.lmol•L-1Na2CO3和NaHCO3混合液中:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| D. | 在反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,5molFeS2发生反应,有14mol电子发生转移 |
| A. | 元素的相对原子质量的递增 | |
| B. | 元素的原子半径呈周期性变化 | |
| C. | 元素原子的最外层电子排布呈周期性变化 | |
| D. | 元素的金属性和非金属性呈周期性变化 |
| A. | 离子晶体中只有离子键 | |
| B. | 非金属元素只能形成共价键 | |
| C. | 水分子中存在氢键,所以水的沸点较高 | |
| D. | 原子晶体的熔点不一定比金属晶体的熔点高 |
 ,雷电作用能进行氮的固定,写出反应方程式N2+O2
,雷电作用能进行氮的固定,写出反应方程式N2+O2