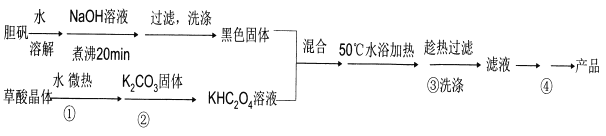
题目内容
【题目】某次实验需用80mL、3mol/L 的稀H2SO4溶液,某同学用98%的浓H2SO4(ρ=1.84g/cm3)进行配制,请回答下列问题:
(1)98%的浓H2SO4(ρ=1.84g/cm3)的物质的量浓度为________。
(2)配制80mL、3mol/L 的稀H2SO4溶液,则需取98%的浓H2SO4________mL,量取浓硫酸所用的量筒的规格是________(从下列中选用)A.10mL B.25mL C.50mL D.100mL
(3)将下列步骤中的空格补充填写完整
①用量筒量取所需的浓硫酸
②将烧杯中的溶液__________________________________________________
③将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌
④将溶液冷却,恢复至室温
⑤向容量瓶中加入蒸馏水_____________________________________________
⑥盖好瓶塞,反复上下颠倒,摇匀
⑦洗涤烧杯2~3次,洗涤液也注入容量瓶中.轻轻摇动容量瓶,使溶液混合均匀.
(4)实验中上述步骤的正确排序为________(填序号)
(5)下列各种情况使所配制溶液浓度偏高的__________________
A.未经冷却趁热将溶液注入容量瓶中
B将量筒中残留的浓硫酸洗涤后.转移入容量瓶中
C.定容时仰视液面读数
D量取浓硫酸时俯视读数
(6)取用任意体积的所配3mol/L硫酸溶液时,下列物理量中不随所取体积的多少而变化的是_______(填字母)
A、溶液中H2SO4的物质的量 B、溶液的浓度 C、溶液中SO42的数目D、溶液的密度
【答案】18.4mol/L16.3mlB用玻璃棒引流转移入100mL容量瓶中至距离刻度线1-2cm处,改用胶头滴管滴加蒸馏水至凹液面最低点与刻度线及视线平齐①③④②⑦⑤⑥ABBD
【解析】
(1)根据c=![]() ,故物质的量浓度为18.4mol/L.
,故物质的量浓度为18.4mol/L.
(2)实验室中没有80mL的容量瓶,因此需要选用100mL的容量瓶,稀释过程中,溶质的物质的量不变,因此100×10-3L×3mol/L=V(H2SO4)×18.4mol/L,解得V(H2SO4)=16.3mL,所选用量筒的规格应为25mL,综上所述,本题应选B;
(3)配制步骤有量取,稀释,移液,洗涤,定容,摇匀等操作,一般用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,将浓硫酸沿烧杯内壁慢慢注入盛有少量水的烧杯中,边加边用玻璃棒搅拌,冷却后转移到容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2~3次,并将洗涤液也全部转移到容量瓶中,向容量瓶中加蒸馏水,当加水至液面距离刻度线时,改用胶头滴管滴加,使溶液的凹液面正好跟刻度相平,盖好容量瓶塞,反复颠倒摇匀,将配好的稀硫酸倒入试剂瓶中,贴好标签,贮存.
故将烧杯中的溶液转移到的容量瓶中,向容量瓶中加入蒸馏水,在距离刻度时,改用胶头滴管加蒸馏水至刻度线。故答案应为:玻璃棒引流转移入100mL容量瓶中;至距离刻度线1-2cm处,改用胶头滴管滴加蒸馏水至凹液面最低点与刻度线及视线平齐;
(4)由以上实验步骤可知,实验操作正确的顺序为:①③④②⑦⑤⑥.
(5)A、未经冷却趁热将溶液注入容量瓶中,由于热胀冷缩,导致定容体积减小,最终溶液浓度偏高;
B、将量筒中残留的浓硫酸洗涤后,转移入容量瓶中,导致浓硫酸物质的量增加,最终溶液的浓度偏高;
C、定容时仰视液面读数,导致溶液体积偏大,最终溶液浓度偏低;
D、量取浓硫酸时俯视读数,导致浓硫酸物质的量偏小,最终溶液浓度偏低;
综上所述,本题应选AB;
(6)溶液的浓度和密度不会随溶液体积变化,而溶液中溶质的物质的量n=c×V,因此与体积有关,溶液中粒子数目N=n.NA =c×V×NA ,因此粒子数目也与体积有关;
综上所述,本题应选BD。

 名校课堂系列答案
名校课堂系列答案