题目内容
短周期元素X、Y、Z在周期表中位置如图。下列说法正确的是( )
| A.若它们均为金属元素,则X与氧元素组成的物质有多种 |
| B.若它们的原子最外层电子数之和为11,则它们均为非金属元素 |
| C.Z单质一定不能置换出Y单质。 |
| D.Z元素的最高化合价一定等于Y元素 |
A
解析试题分析:A项若它们均为金属元素,则X为Na、Y为Mg、Z为Be,X(Na)与氧元素组成的物质有Na2O、Na2O2,正确;B项若它们的原子最外层电子数之和为11,则X为Al、Y为Si、Z为C,错误;C项一般情况下Z单质能置换出Y单质,错误;D项当Z为氧或氟元素时,由于这两种元素没有正价,其最高价与Y的最高价就有可能不相等,错误。
考点:考查元素周期表和元素周期律的应用。

练习册系列答案
相关题目
根据元素周期表和元素周期律分析,下列推断中错误的是( )
| A.铍的原子失去电子能力比镁弱 | B.砹的氢化物不稳定 |
| C.硒化氢比硫化氢稳定 | D.氢氧化锶比氢氧化钙的碱性强 |
下表为六种短周期元素的部分性质:
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.74 | 0.75 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
A.X与Y可以形成阴离子XY32-
B.元素R的氧化物对应水化物一定为强酸
C.Z的氢化物的沸点比T的氢化物的沸点高
D.由X形成的化合物QX和XR4,其晶体类型不相同
下列选项中与主族元素在元素周期表中所处的位置相关的是
| A.相对原子质量 | B.核内中子数 |
| C.次外层电子数 | D.电子层数和最外层电子数 |
有关叙述:能说明M比N的非金属性强的叙述是
①非金属单质M能从N的化合物中置换出非金属单质N。
②M原子比N原子容易得到电子。
③单质M跟H2反应比N跟H2反应容易得多。
④气态氢化物水溶液的酸性HmM>HnN。
⑤最高价氧化物对应水化物的酸性HmMOx>HnNOy。
⑥熔点M>N。
| A.①②③⑤ | B.②⑤ |
| C.①②③④⑤ | D.全部 |
下列比较或归纳正确的是( )
| A.稳定性:NH3<PH3<ASH3 |
| B.离子半径:Cl->S2->Al3+ |
| C.酸性:HClO4>H2SO4>H3PO4 |
| D.碱性:Be(OH)2>Mg(OH)2>Al(OH)3 |
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是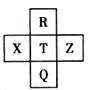
| A.非金属性:Z<T<X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R<T<Q |
| D.最高价氧化物的水化物的酸性:Q>T |
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
| A.同周期元素中X的金属性最强 |
| B.同周期元素中Y的最高价含氧酸的酸性最强 |
| C.原子半径X>Y,离子半径X+>Z2- |
| D.同族元素中Z的氢化物稳定性最高 |