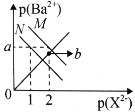
题目内容
【题目】无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为___________。
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3 、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
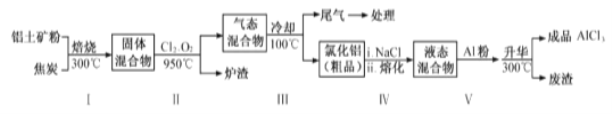
已知:

①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是_____(只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是_____。
③步骤Ⅲ的尾气经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为_________________________。
④结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是_________。
【答案】Al3++3H2OAl(OH)3+3H+ 防止后续步骤生成的AlCl3水解或增大反应物的接触面积,加快反应速率 Fe或铁 NaCl、NaClO、Na2CO3 除去FeCl3,提高AlCl3纯度
【解析】
(1)胶体具有吸附性,氯化铝能净水是因为:氯化铝为强酸弱碱盐,铝离子能水解生成氢氧化铝胶体,据此书写水解方程式;
(2)用铝土矿制取无水氯化铝工艺流程:铝土矿粉和焦炭在300℃焙烧,固体水分挥发、气孔数目增多,固体混合物和氯气、氧气在950℃加热,Al2O3、Fe2O3和SiO2先被焦炭还原为Al、Fe、Si,生成CO,后Al、Fe、Si分别和Cl2反应生成对应的氯化物,即SiCl4、AlCl3、FeCl3,CO和O2反应生成CO2,后冷却到100℃,尾气为CO2、多余的Cl2,O2,SiCl4,以及AlCl3和FeCl3变成固体,得到氯化铝的粗品,加入氯化钠熔融,铝的金属活动性强于铁,加铝粉,可以将氯化铝的粗品中的氯化铁中的铁置换出来,生成铁和氯化铝,在300℃,废渣为Fe,得到成品氯化铝。
(1)氯化铝是强酸弱碱盐,在溶液中铝离子发生水解反应产生氢氧化铝胶体,胶体具有吸附性,所以能净水,其反应的离子方程式为:Al3++3H2OAl(OH)3+3H+,故答案为:Al3++3H2OAl(OH)3+3H+;
(2)①步骤1中铝土矿粉和焦炭在300℃焙烧,因后续步骤反应生成氯化铝等强酸弱碱盐易水解,固体水分在焙烧的过程中挥发,防止后续步骤生成的盐水解、气孔数目增多增大反应物的接触面积,加快反应速率,故答案为:防止后续步骤生成的AlCl3水解或增大反应物的接触面积,加快反应速率;
②根据物质中含有的元素组成可知:若步骤Ⅱ中不通入氯气和氧气,Fe2O3与焦炭发生氧化还原反应,则反应生成相对原子质量比硅大的单质是铁,故答案为:Fe或铁;
③④步骤Ⅲ经冷却至室温后,气体用足量的NaOH冷溶液吸收,Cl2和NaOH溶液反应生成NaCl、NaClO和H2O,CO2和NaOH溶液反应生成Na2CO3和H2O,所以生成的盐的化学式为NaCl、NaClO和Na2CO3,故答案为:NaCl、NaClO、Na2CO3;
④步骤Ⅲ得到氯化铝的粗品,加入氯化钠熔融能降低FeCl3的熔点,铝的金属活动性强于铁,加铝粉,可以将氯化铝的粗品中的氯化铁中的铁置换出来,生成铁和氯化铝,因AlCl3在180℃升华,在300℃,废渣为Fe,冷却得到成品氯化铝,故答案为:除去FeCl3,提高AlCl3纯度。

【题目】现有下列十种物质:①乙醇 ②铜 ③CaO ④CO2 ⑤食醋 ⑥Ba(OH)2⑦红褐色氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩硫酸铁
(1)按物质的分类方法填写表格的空白处:
分类标准 | _______ | 氧化物 | _____ | _____ | 电解质 | 非电解质 |
物质 | ② | _____ | ⑤⑧⑨ | ⑦ | _____ | _____ |
(2)上述十种物质中有两种物质之间可发生离子反应:OH-+ H+=H2O,该反应对应的化学方程式为________________________________。
(3)少量的②加入的溶液中反应⑩的离子方程式为____________________________。